Glioblastome sind Hirntumoren mit einem besonders schweren und zumeist tödlichen Verlauf. Sie wachsen diffus ins gesunde Gehirn ein und lassen sich daher durch eine Operation kaum vollständig entfernen. Selbst den bestmöglichen chirurgischen, chemo- und strahlentherapeutischen Behandlungen widersetzen sie sich schnell und immer wieder. Auch moderne Immuntherapien, die bei anderen Krebsarten teilweise gute Erfolge erzielen, schlagen nicht an. Die zugrundeliegenden Ursachen sind bis heute nicht eindeutig geklärt.
“Glioblastome schaffen sich offenbar eine Umgebung, die aktiv die Immunabwehr unterdrückt, sagt Björn Scheffler, DKTK Professor für Translationale Onkologie am Westdeutschen Tumorzentrum in Essen, Partnerstandort Essen/Düsseldorf. “Sie produzieren immunsuppressive Botenstoffe und in der direkten Umgebung der Tumoren finden wir bestimmte Arten von Immunzellen, die die Abwehr gezielt drosseln.“
Die Vielfalt von Immunzellen in der Mikroumgebung von Glioblastomen war bislang nicht im Detail bekannt. Doch um die tumorbedingte Immunsuppression mit geeigneten Therapien umgehen zu können, ist zunächst eine genaue Kenntnis der zellulären Komposition der Glioblastome erforderlich, erkannten Scheffler und Kollegen.
An Gewebeproben von 217 Glioblastomen, 86 WHO Grad II und III Astrozytomen und 17 Proben von gesundem Gehirngewebe erstellten die DKTK-Forscher nun auf der Basis von computergestützten Transkriptionsanalysen Profile der zellulären Zusammensetzung. Die Gewebeproben waren direkt an den Operationsrändern entnommen worden - wo verbliebene Tumorzellen und Immunzellen aufeinandertreffen.
Das Team konnte die Signale von 43 Zelltypen, darunter allein 26 verschiedenen Arten von Immunzellen, unterscheiden. Zu ihrer großen Überraschung entdeckten die Wissenschaftler in allen Proben von bösartigen Tumoren Stammzellen und Vorläuferzellen des blutbildenden Systems. In gesunden Gewebeproben war dieser Zelltyp dagegen nicht nachweisbar. “Blutstammzellen sind eigentlich im Knochenmark angesiedelt und versorgen von dort aus den Körper mit allen Arten reifer Blutzellen - darunter natürlich auch alle verschiedenen Arten von Immunzellen. Hirntumor-eigene Blutstammzellen sind bisher noch nie beschrieben worden“, so die Erstautorin Celia Dobersalske.
Noch erstaunlicher war die Beobachtung, dass diese Blutstammzellen offenbar fatale Eigenschaften haben: Sie unterdrücken das Immunsystem und befeuern gleichzeitig das Tumorwachstum: Züchteten die Forscher die tumorassoziierten Blutstammzellen gemeinsam mit Glioblastomzellen in derselben Kulturschale, so steigerte sich die Teilungsaktivität der Krebszellen. Gleichzeitig produzierten sie große Mengen des als “Immunbremse“ bekannten Moleküls PD-L1 auf ihrer Oberfläche.
Auch sogenannte Tumor-Organoide - Minitumoren, die in der Kulturschale aus Hirntumorzellen einzelner Patienten gezüchtet wurden - reagierten auf die Blutstammzellen: In deren Gegenwart bildeten die Krebszellen ein Netzwerk aus Zellfortsätzen, dass sie untereinander verbindet. Wissenschaftler vom DKFZ und vom Heidelberger Universitätsklinikum hatten vor wenigen Jahre erst entdeckt, dass Glioblastomzellen über diese Verbindungen kommunizieren und sich dadurch vor therapiebedingten Schäden schützen.
Alle diese Beobachtungen legten die Vermutung nahe, dass die in Glioblastomen vorkommenden Blutstammzellen den Verlauf der Erkrankung negativ beeinflussen. Dieser Verdacht bestätigte sich bei einer Untersuchung an 159 Glioblastom-Patienten, deren Daten zum klinischen Verlauf der Krebserkrankung verfügbar waren: Bei dieser Patientengruppe zeigte sich durchgehend: Je mehr Blutstammzellen ein Tumor enthielt, desto mehr immunsuppressive Botenstoffe wurden ausgeschüttet, desto mehr immunbremsende Marker bildeten die Krebszellen - und desto geringer war das Gesamtüberleben der Patienten.
Um Hirntumor-Blutstammzellen näher zu untersuchen, extrahierten die Autoren zusammen mit Kollegen um Ulrich Sure, Direktor der Klinik für Neurochirurgie am Universitätsklinikum Essen, einzelne Zellen aus frischem Patientengewebe. Durch die Sequenzierung der Genexpression von 660 individuellen Zellen konnten die Forscher ein Profil erstellen und mit Zellen aus dem gesunden Knochenmark und Blut vergleichen. Die Analyse dieser Daten erbrachte einige konkrete neue Ansätze, wie diese tumorfördernde Zellpopulation unschädlich gemacht werden könnte.
Aus Forschungsberichten war bereits bekannt, dass die Blutstammzellen im Knochenmark im Verlauf von Krebserkrankungen bei ihrer Differenzierung bevorzugt zu immunsuppressiven Zelltypen ausreifen. Offenbar werden sie vom Tumor entsprechend programmiert. Ein ähnliches Phänomen könnte bei den Glioblastom-assoziierten Blutstammzellen vorliegen, vermute der Experte und Letztautor Igor Cima. “Wir sehen nun die Chance, modulierend in den Differenzierungsprozess der gliomassoziierten Blutstammzellen einzugreifen, beispielsweise durch bestimmte Zellbotenstoffen, und damit die tumorbedingte Immunblockade zu umgehen. Dann hätten Immuntherapien gegen das Glioblastom eine bessere Chance auf Wirksamkeit.“
Die Arbeit wurde gefördert von der Wilhelm Sander-Stiftung.
I-Na Lu, Celia Dobersalske, Laurèl Rauschenbach, Sarah Teuber-Hanselmann, Anita Steinbach, Vivien Ullrich, Shruthi Prasad, Tobias Blau, Sied Kebir, Jens T. Siveke, Jürgen C. Becker, Ulrich Sure, Martin Glas, Björn Scheffler and Igor Cima: Tumor-associated hematopoietic stem and progenitor cells positively linked to glioblastoma progression Nature Communications 2021, DOI: 10.1038/s41467-021-23995-z
Ein Bild zur Pressemitteilung steht zum Download zur Verfügung: Scheffleer-lab_PM.png
Bildunterschrift:
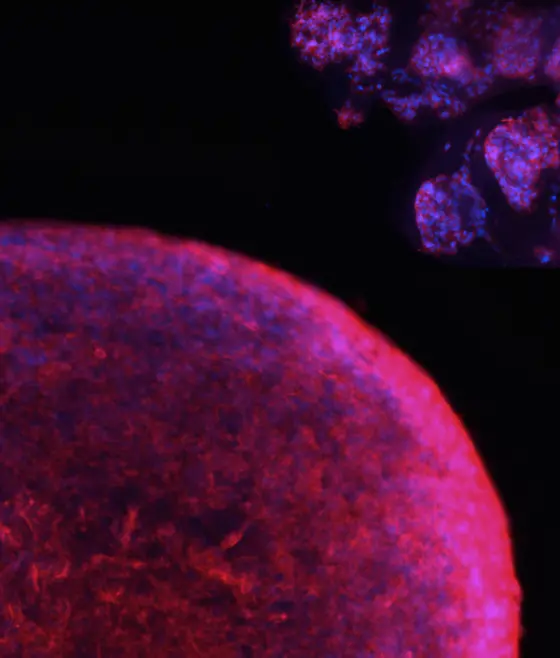
Die Abbildung zeigt eine Kollage Fluoreszenz-markierter Tumor-Organoide, die im Scheffler Labor aus Patientenzellen als “Mini-Hirntumor“ für die Forschung gezüchtet werden.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: “Quelle: K. Stratmann und C. Dobersalske“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.