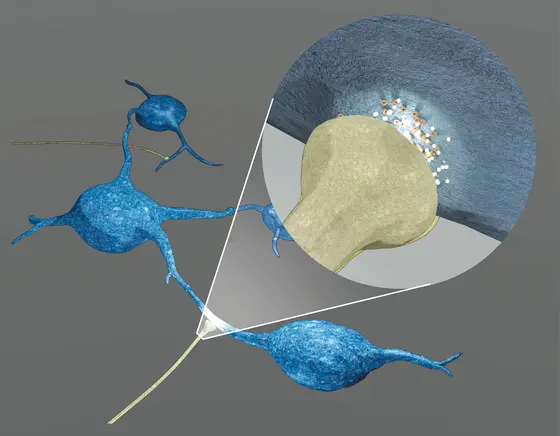
Nervenzellen geben ihre Signale über Synapsen – feine Zellausläufer mit Kontaktknöpfchen, die der nächsten Nervenzelle aufliegen – untereinander weiter. Wissenschaftler und Ärzte des Universitätsklinikums sowie der Medizinischen Fakultät Heidelberg und des Deutschen Krebsforschungszentrums haben nun entdeckt, dass Nervenzellen des Gehirns auch mit Tumorzellen aggressiver Glioblastome solche direkten Zell-Zell-Kontakte ausbilden. Auf diesem Weg geben sie Erregungsreize an die Krebszellen weiter. Von diesem „Input“ profitiert der Tumor: Die Aktivierungssignale sind wahrscheinlich eine treibende Kraft für Tumorwachstum und die Invasion von Tumorzellen in gesundes Hirngewebe, wie die Teams um Prof. Dr. Frank Winkler und Prof. Dr. Thomas Kuner mit Hilfe spezieller bildgebender Verfahren herausfanden. Doch es gibt auch gute Nachrichten: Mit bestimmten Wirkstoffen lässt sich die Signalübertragung im Tierversuch blockieren. Die Ergebnisse sind aktuell online in der Fachzeitschrift „Nature“ erschienen.
Tumorzellen: Untereinander im Gehirn ähnlich vernetzt wie Nervenzellen
Glioblastome wachsen wie ein Pilzgeflecht diffus in das gesunde Gehirn ein. Daher lassen sie sich durch eine Operation nicht vollständig entfernen und überstehen auch eine intensive Chemo- und Strahlentherapie. Somit gehören Glioblastome zu den gefährlichsten Tumoren des Menschen mit einer durchschnittlichen Überlebenszeit von 15 Monaten nach Erstdiagnose.
Das Team unter Leitung von Frank Winkler, Arbeitsgruppenleiter in der Klinischen Kooperationseinheit Neuroonkologie, entdeckte 2015 eine Ursache für diese Therapie-resistenz: Die Glioblastomzellen sind untereinander durch lange Zellfortsätze verbunden. Über diese Verschaltung kommunizieren sie, tauschen für ihr Überleben relevante Stoffe aus und schützen sich so vor therapiebedingten Schäden. Die aktuellen Erkenntnisse ergänzen einen weiteren Mosaikstein zum Verständnis dieser Krebserkrankung: „Die Tumorzellen sind nicht nur ähnlich wie Nervenzellen im Gehirn untereinander vernetzt, sie empfangen auch direkte Signale von ihnen“, erläutert Winkler, dessen Forschungsgruppe am Universitätsklinikum und am Deutschen Krebsforschungszentrum angesiedelt ist.
Die Forscher beobachteten das Wachstum menschlicher Glioblastome, die sie auf Mäuse übertragen hatten und untersuchten Zellkulturen mit menschlichen Nerven- und Tumorzellen sowie Gewebeproben von Patienten. Sie nutzten dazu eine breite Palette moderner Mikroskopietechniken, die einerseits detaillierte und dreidimensionale Einblicke auf die mikrometerkleinen Verbindungen zwischen Nerven- und Tumorzellen ermöglichen und andererseits auch deren molekulare Zusammensetzung sowie Signale innerhalb der Zellen darstellen können. Elektrische Ableitungen von Tumorzellen enthüllten selbst kleinste Stromflüsse der synaptischen Verbindungen, die den Ausgangspunkt für die weitere Verarbeitung dieser Signale in den Tumorzellen darstellen. „Wir konnten zeigen, dass die Signalübertragung von Nervenzellen auf Tumorzellen tatsächlich so funktioniert wie bei erregenden Synapsen zwischen den Nervenzellen“, so Thomas Kuner, Leiter der Abteilung Funktionelle Neuroanatomie am Institut für Anatomie und Zellbiologie, wo die synaptischen Verbindungen von Dr. Varun Venkataramani erstmalig entdeckt wurden. „Dieses Projekt begann mit einer Beobachtung in der Grundlagenforschung und hat in enger Zusammenarbeit mit unseren klinischen Partnern zu konzeptionell neuen Einsichten geführt, welche nun durch gezielte translationale Forschung die Entwicklung neuer Therapieansätze ermöglichen können.“
Ein fataler Mechanismus, der jedoch Ansatzpunkte für neue Therapien liefert
Wie genau die Aktivierung der Tumorzelle schließlich zu verstärktem Tumorwachstum und Wanderung der Gliomzellen in gesunde Gehirnareale führt, ist noch nicht geklärt. Klar ist dagegen, dass sich dieser Mechanismus im Tierversuch blockieren lässt. Mögliche Wege sind die deutliche Reduktion der Gehirnaktivität z.B. während einer Narkose, pharmakologische Eingriffe, die die Bindung der Signalübertragungsstoffe am sogenannten AMPA-Rezeptor unterbrechen, oder das Ausschalten des AMPA-Rezeptors mit gentechnischen Methoden. In allen Fällen verlangsamte sich im Tierversuch die Ausbreitung des Tumors. „Dieser Mechanismus ist damit ein ausgesprochen interessanter Ansatz für die Wirkstoffentwicklung und zukünftige, medikamentöse Therapien“, betont Neuroonkologe Winkler. „Tatsächlich sind bereits passende Substanzen zugelassen, die den AMPA-Rezeptor blockieren und in der Behandlung anderer neurologischer Erkrankungen zum Einsatz kommen. Das sind vielversprechende Kandidaten für klinische Studien.“
„Die neuen Erkenntnisse zeigen nicht nur, was Glioblastome so aggressiv macht, sondern auch, wie man sie konkret ausbremsen könnte. Das hat große translationale Relevanz und öffnet die Tür für zeitnah einsetzende klinische Studien“ sagt Prof. Dr. Wolfgang Wick, Ärztlicher Direktor der Neurologischen Universitätsklinik Heidelberg und Leiter der Klinischen Kooperationseinheit. „Zudem ist es höchst erfreulich, dass die Arbeit unseres Nachwuchswissenschaftlers Varun Venkataramani, der gleichzeitig auch klinisch tätig ist, durch eine Publikation in einem so hochrangigen Journal wie Nature gewürdigt wird.“
Die Relevanz der Heidelberger Ergebnisse bestätigt eine Arbeit aus der Stanford University, Kalifornien, USA: Das Forschungsteam um Prof. Michelle Monje fand an bislang unheilbaren kindlichen Hirntumoren ebenfalls synaptische Verbindungen zwischen Nerven- und Tumorzellen und beobachtete auch die von den Heidelberger Forschern beschriebenen Therapieeffekte. Beide Arbeiten werden zeitgleich in „Nature“ veröffentlicht.
Originalpublikation:
https://nature.com/articles/s41586-019-1564-x
Weitere Informationen:
www.klinikum-heidelberg.de/Neuroonkologie
www.dkfz.de/en/neuroonkologie/AG_Winkler.html
http://www.ana.uni-heidelberg.de/?id=164