Obgleich seit Langem intensiv erforscht, zählt das Glioblastom auch heute noch zu den gefährlichsten aller Tumoren. Oft liegt die Lebenserwartung der Betroffenen nach Diagnosestellung nur bei gerade mal einem Jahr.
Um so aggressiv und schnell wachsen zu können, benötigen die Glioblastomzellen sehr viel Energie, die sie überwiegend aus einem veränderten Fettsäure-Stoffwechsel beziehen. Wird ihnen dieser Weg der Energiegewinnung genommen, so verlangsamt sich das Wachstum der Krebszellen.
An diesen Zusammenhang dachten auch die Wissenschaftler vom Deutschen Krebsforschungszentrum (DKFZ), die in ihrer aktuellen Arbeit die Produktion eines Zellproteins namens Acyl-CoA-bindendes Protein (ACBP) in Mäusen untersuchten. Dabei zeigte sich, dass ACBP offensichtlich die Verfügbarkeit von Fettsäuren in den Mitochondrien, den „Kraftwerken der Zelle“, kontrolliert. Was also würde passieren, wenn ACBP ausgeschaltet würde?
„Es gelang uns schließlich, das ACBP in unseren Mäusen gezielt genetisch ganz auszuschalten. Dies führte dazu, dass die Tiere plötzlich länger lebten, weil der Tumor weniger Energie zur Verfügung hatte und dadurch weniger gut wachsen konnte“, so Julieta Alfonso vom DKFZ in Heidelberg, die Letztautorin der Studie.
In mehreren präklinischen Untersuchungen konnten die Autoren um Alonso nun zeigen: Wird den Glioblastomen durch ACBP-Blockade die Versorgung mit Fettsäuren und damit die Energiequelle entzogen, so wachsen die Tumorzellen langsamer und die Überlebenszeit der Mäuse verlängert sich entsprechend.
„Unsere Studie hat eine kritische Verbindung zwischen dem Fettsäure-Stoffwechsel und dem aggressiven Wachstum der Glioblastome aufgedeckt. In Zukunft könnte das ACBP möglicherweise ein neues therapeutisches Ziel bei der Behandlung dieser bisher nur schlecht behandelbaren Krebsart darstellen“, fasst Julieta Alfonso die Bedeutung der Arbeit abschließend zusammen.
Allerdings macht die Wissenschaftlerin darauf aufmerksam, dass vorab noch viele Fragen geklärt werden müssen: So existiert bislang noch kein Wirkstoff, der die Aktivität von ACBP hemmt. Daher können die Wissenschaftler derzeit noch keine Aussagen darüber machen, mit welchen Nebenwirkungen eine ACBP-Hemmung im ganzen Körper verbunden wäre.
Ceren Duman, Kaneschka Yaqubi, Angelika Hoffmann, Azer Aylin Acikgöz Andrey Korshunov, Martin Bendszus, Christel Herold-Mende Hai-Kun Liu, and Julieta Alfonso:
Acyl-CoA-Binding Protein Drives Glioblastoma Tumorigenesis by Sustaining Fatty Acid Oxidation.
Cell Metabolism 2019, 10.1016/j.cmet.2019.04.004
Ein Bild zur Pressemitteilung steht zum Download zur Verfügung:
Brain-Tumor-in-mouse.jpg
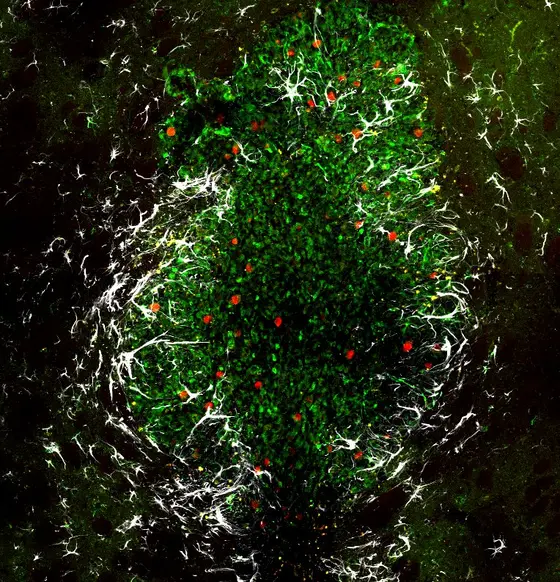
BU: Glioblastom im Gehirn einer Maus: Grün dargestellt sind die Tumorzellen, rote Farbe zeigt Zellteilungen an, die Astrozyten erscheinen weiß.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: J. Alfonso/ DKFZ“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.