Hirntumoren aus der Gruppe der unheilbaren Astrozytome, zu denen auch die besonders bösartigen Glioblastome zählen, wachsen wie ein Pilzmyzel diffus in das gesunde Gehirn ein. Daher lassen sie sich durch eine Operation nicht vollständig entfernen und wachsen trotz intensiver Therapie weiter – sie besitzen offenbar wirksame Resistenzmechanismen.
Wissenschaftler um Frank Winkler von der Neurologischen Universitätsklinik Heidelberg und vom Deutschen Krebsforschungszentrum beschreiben in ihrer aktuellen Arbeit eine verblüffende Eigenschaft der Astrozytomzellen: Sie bilden extrem dünne und lange Fortsätze ihrer Zellmembran aus, mit denen sie das gesunde Gehirn durchdringen, es ständig abtasten, und schließlich kolonisieren.
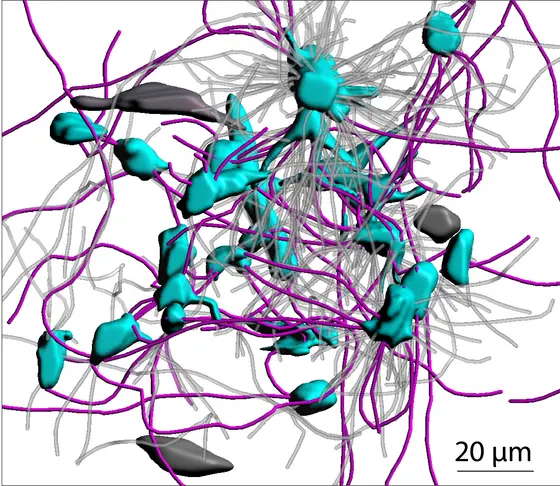
Mit zunehmendem Tumorwachstum verbinden sich die Krebszellen mit diesen Fortsätzen zu einem großen Netzwerk. In diesem Netzwerk kommunizieren sie so intensiv über so lange Distanzen, dass man Astrozytome als hochkomplexe, organähnliche Strukturen verstehen kann. „Unser erster Gedanke war: das sieht ja aus wie die Neubildung eines Gehirns im bestehenden Gehirn“, berichtet Frank Winkler. „Die Tumorzellen waren stark untereinander vernetzt, so wie wir das von Nervenzellen im Gehirn kennen.“
Die Forscher beobachteten bis über ein Jahr hinweg das Wachstum menschlicher Glioblastome, die sie auf Mäuse übertragen hatten. Sie nutzten dazu eine spezielle Mikroskopietechnik, die Einblicke in tiefe Zonen des Gehirns ermöglicht. So fanden sie heraus, dass die Tumorzellen Moleküle über die Membranschläuche austauschten und sie darüber hinaus als Kommunikationskanäle nutzen.
Auch im Gewebe von Hirntumor-Patienten entdeckten die Forscher das Netzwerk aus Membranfortsätzen. Je vernetzter die Krebszellen waren, desto bösartiger und resistenter war der Hirntumor-Typ.
Die Wissenschaftler vermuteten daher rasch, dass die Netzwerke aus Membranfortsätzen mit der Therapieresistenz im Zusammenhang stehen müssen. Tatsächlich erkennen die Tumore eine Schädigung des Netzwerks und reparieren es umgehend. Eine Bestrahlung – die Standardtherapie beim Glioblastom – überleben vor allem diejenigen Tumorzellen, die Teil des Netzwerkes sind, unvernetzte Krebszellen dagegen sterben.
Wie kommen die Tumorzellen zu ihren ungewöhnlichen Membranfortsätzen? Einen Hinweis darauf ergab die Analyse der Genaktivitäten von 250 Hirntumorpatienten. Die Krebszellen missbrauchen bestimmte molekulare Signalwege, die normalerweise an der frühen Entwicklung des Nervensystems beteiligt sind, für ihre Vernetzung. Nach einer experimentellen Blockade dieser Signalwege entwickelten die Mäuse geringer vernetzte kleinere Tumoren, die sehr stark auf Strahlentherapie ansprachen.
„Die Resistenz der Astrozytome, insbesondere der Glioblastome, gegen alle Therapieformen ist ein enormes Problem. Unsere Ergebnisse zeigen uns erstmals einen lang gesuchten neuen Ansatz auf, diese Resistenz zu brechen, um die Tumoren zukünftig möglicherweise besser behandeln zu können. Zudem zeigen die Ergebnisse, warum eine molekular definierte Subgruppe von Hirntumoren deutlich stärker von der Therapie profitiert. Bei ihnen scheint die Möglichkeit zur Netzwerkbildung begrenzt zu sein“, sagt Wolfgang Wick, Leiter der Klinischen Kooperationseinheit und der Neurologischen Universitätsklinik Heidelberg.
Matthias Osswald, der Erstautor der Arbeit, ergänzt: „Auch wenn wir mit dieser Entdeckung unseren Hirntumorpatienten noch nicht unmittelbar helfen können, wissen wir doch zumindest, in welche Richtung künftige Therapien entwickelt werden sollten: Wir müssen das bösartige Netzwerk zerstören.“
Matthias Osswald, Erik Jung, Felix Sahm, Gergely Solecki, Varun Venkataramani, Jonas Blaes, Sophie Weil, Heinz Horstmann, Benedikt Wiestler, Mustafa Syed, Lulu Huang, Miriam Ratliff, Kianush Karimian Jazi, Felix T. Kurz, Torsten Schmenger, Dieter Lemke, Miriam Gömmel, Martin Pauli, Yunxiang Liao, Peter Häring, Stefan Pusch, Verena Herl, Christian Steinhäuser, Damir Krunic, Mostafa Jarahian, Hrvoje Miletic, Anna S. Berghoff, Oliver Griesbeck, Georgios Kalamakis, Olga Garaschuk, Matthias Preusser, Samuel Weiss, Haikun Liu, Sabine Heiland, Michael Platten, Peter E. Huber, Thomas Kuner, Andreas von Deimling, Wolfgang Wick und Frank Winkler: Brain tumor cells interconnect to a functional and resistant network. Nature 2015, DOI:10.1038/nature16071
Link zum Kommentar in Nature (“News and Views"): http://www.nature.com/nature/journal/vaop/ncurrent/full/nature15649.html
Ein Bild zur Pressemitteilung steht zur Verfügung unter:
vernetztes-Glioblastom.jpg
3D-Darstellung eines Glioblastoms: Vernetzte Krebszellen (blau) sind über lange Membranfortsätze (pink) miteinander verbunden. Unvernetzte Tumorzellen sind dunkelgrau, Membranfortsätze, die keine Zellen verbinden, hellgrau dargestellt. (M. Osswald/DKFZ).