In allen Zellen – vom Bakterium bis zum Menschen – entstehen Proteine zunächst als lange Ketten aneinandergereihter Aminosäuren. Anschließend müssen sie eine bestimmte dreidimensionale Form annehmen, sich also falten, um ihre Aufgabe erfüllen zu können. Schadhafte Proteine verlieren ihre Struktur und entfalten sich. Dabei besteht die Gefahr, dass sie miteinander verklumpen. „Bilden sich solche Aggregate in großer Menge, kann das die Zellen schädigen oder sogar zum Zelltod führen. Das ist bei neurodegenerativen Erkrankungen, etwa Alzheimer und Parkinson, oder auch bei Vorgängen des Alterns der Fall“, erklärt Professor Bernd Bukau, Direktor des Zentrums für Molekulare Biologie der Universität Heidelberg (ZMBH) und zugleich Abteilungsleiter am Deutschen Krebsforschungszentrum (DKFZ).
Wie Bukau erläutert, verklumpen schadhafte Proteine nicht nur während des Alterns, sondern auch, wenn die Proteinstruktur durch Mutation verändert ist oder chemische oder umweltbedingte Belastungen auftreten. So kann zum Beispiel ein Anstieg der Umgebungstemperatur dazu führen, dass Proteine ihre Struktur verlieren und sich entfalten. „Die Bildung von Proteinaggregaten in verschiedenen Organen des menschlichen Körpers spielt bei vielen menschlichen Erkrankungen eine Rolle, zu denen auch Stoffwechselstörungen gehören“, so der Biologe.
Bislang war wenig darüber bekannt, wie das natürliche Abwehrsystem des Menschen das Verklumpen der Proteine in jungen gesunden Zellen wirksam umkehrt. „Aggregate von Proteinen aufzulösen, ist für die Zellen ein entscheidender Schritt, um schadhafte Proteine “wiederzuverwerten“ und sich vor Zellschädigungen zu schützen. Wir hatten mehrere Hinweise darauf, wer die Hauptbeteiligten sind, wussten aber nicht, wie der Prozess konkret abläuft“, sagt der Leiter der Untersuchungen, Dr. Nadinath Nillegoda, aus dem Team von Bernd Bukau. Den Forschern ist es nun gelungen, einen bisher unbekannten und aus mehreren Komponenten aufgebauten Proteinkomplex zu identifizieren, der unter Kultur-Bedingungen wirksam Proteinaggregate auflöst.
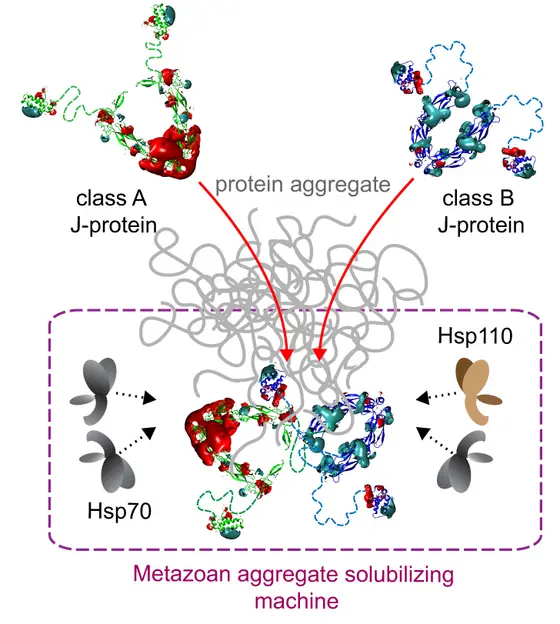
Dieser Komplex besteht aus molekularen Faltungshelfern, den Chaperonen, die in diesem Fall zur Klasse der Hitzeschockproteine 70 (Hsp70) gehören. Es handelt sich also um Helfer-Proteine, die anderen Proteinen bei der Faltung helfen. Außerdem gehören zu dem Proteinkomplex Co-Chaperone, die die Hsp70-Aktivität regulieren. Von zentraler Bedeutung sind hier, so Bukau, die Co-Chaperone der sogenannten J-Proteinfamilie, die den Faltungshelfer Hsp70 an die Proteinaggregate „locken“ und dort zielgenau aktivieren. „Der Schlüsselbefund unserer Arbeit ist, dass zwei Typen dieser J-Proteine dynamisch miteinander wechselwirken müssen, um die Faltungshelfer Hsp70 maximal zu aktivieren. Erst dadurch entsteht ein wirksamer Komplex, der die Aggregate auch tatsächlich auflösen kann.“
Die computerbasierte Analyse der Daten übernahmen Wissenschaftler des Heidelberger Instituts für Theoretische Studien (HITS). Sie entwickelten eine spezielle Modellierungsmethode, mit der sie die Bildung der Chaperonkomplexe simulieren konnten. Dieses Modell ermöglichte es Professor Rebecca Wade, die eine Forschungsgruppe am HITS leitet und ebenfalls am ZMBH forscht, die dynamischen Wechselwirkungen der zwei J-Proteintypen im Chaperonkomplex zu verstehen, die die Aktivität aller Faltungshelferproteine koordinieren.
Bukau sieht nun die große Herausforderung darin, das Potential dieses neuentdeckten Mechanismus aus der Grundlagenforschung in den klinischen Bereich zu übertragen, so dass die Erkenntnisse etwa bei der Behandlung von Alzheimer- oder Parkinson-Patienten genutzt werden können. An den aktuellen Arbeiten haben neben den Wissenschaftlern des ZMBH, des DKFZ und des HITS auch Forscher des Leibniz-Instituts für Molekulare Pharmakologie in Berlin, der Northwestern University in Illinois (USA) und der Eidgenössischen Technischen Hochschule Zürich (Schweiz) mitgewirkt.
Originalpublikation:
N. B. Nillegoda, J. Kirstein, A. Szlachcic, M. Berynskyy, A. Stank, F. Stengel, K. Arnsburg, X. Gao, A. Scior, R. Aebersold, D. L. Guilbride, R. C. Wade, R. I. Morimoto, M. P. Mayer and Bernd Bukau: Crucial HSP70 co-chaperone complex unlocks metazoan protein disaggregation. Nature (published online 5 August 2015), doi: doi:10.1038/nature14884
Informationen im Internet:
www.zmbh.uni-heidelberg.de/bukau/default.shtml
Kontakt:
Prof. Dr. Bernd Bukau
Zentrum für Molekulare Biologie der Universität Heidelberg
Telefon (06221) 54-6850
direktor(at)zmbh.uni-heidelberg.de