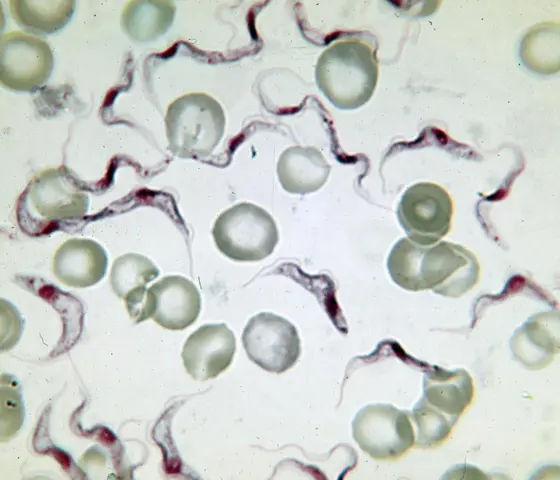
Die Schlafkrankheit ist in großen Teilen des tropischen Afrikas verbreitet. Die von der Tsetse-Fliege übertragenen Erreger, afrikanische Trypanosomen, greifen das zentrale Nervensystem an und verursachen schwere neurologische Störungen. Ohne Behandlung kann die Infektion zum Tod führen.
Seit über hundert Jahren wird das in Deutschland entwickelte Medikament Suramin erfolgreich gegen frühe Stadien der Schlafkrankheit eingesetzt. Bis heute gibt es nur eine Handvoll wirksamer Substanzen gegen die Tropenkrankheit, die WHO zählt Suramin daher zu den lebensnotwendigen Medikamenten.
Doch bislang war unklar, wie das Medikament überhaupt ins Innere des Erregers gelangt und wie es dort wirkt. Wissenschaftler konnten im Labor nun Trypanosomen-Stämme züchten, die hohe Resistenz gegenüber Suramin aufwiesen. Dabei zeigt sich, dass die resistenten Stämme alle eine bestimmte Variante des so genannten „variable surface glycoprotein“ trugen, genannt VSGsur. „Diese Beobachtung legt natürlich nahe, dass VSGsur an der Ausbildung der Suramin-Resistenz beteiligt ist – allerdings hatten wir keine Vorstellung davon, wie das funktionieren könnte“, sagt Erec Stebbins, Strukturbiologe am Deutschen Krebsforschungszentrum.
Mit hochauflösenden Untersuchungen der Kristallstruktur des Proteins konnte Stebbins zeigen, dass die mit der Resistenz verbundenen VSGsur in einem bestimmten Bereich eine grundsätzlich andere Proteinstruktur aufweisen als alle anderen VSGs. Diese Strukturabweichung ermöglicht, dass der Wirkstoff Suramin an das VSGsur binden kann.
Wenn die Wissenschaftler den abweichenden Bereich des VSGsur genetisch modifizierten, reagierten die Trypanosomen wieder empfindlich auf Suramin und der Wirkstoff konnte nicht mehr das VSG binden.
„Wir verstehen noch nicht genau, wie die Suramin-Bindung an VSGsur mit der Resistenz in Verbindung steht“, erklärt Stebbins. „Möglicherweise fängt VSGsur den Wirkstoff ab, so dass nicht mehr genug Suramin im Inneren des Erregers ankommt. Auf jeden Fall werden uns die Ergebnisse helfen, die auch nach 100 Jahren noch rätselhafte Wirkung von Suramin besser zu verstehen.
Bislang hatten Wissenschaftler den VSGs eine einzige Funktion zugemessen: Sie galten als hochwirksamer Schutzmantel der Trypanosomen vor dem Immunsystem des Wirts. Die einzelligen Trypanosomen sind von einer dichten Schicht identischer VSGs bedeckt, gegen die sich die Antikörper der Infizierten richten. Dadurch werden die Parasiten großenteils eliminiert – bis einzelne der Erreger auf ein anderes VSG-Gen umschalten – sie haben hunderte davon zur Verfügung. Dadurch werden die Oberflächenproteine auf dem Einzeller komplett ausgetauscht und die so maskierten Trypanosomen von den Antikörpern nicht mehr erkannt. Sie vermehren sich rasant, und die Infektion, die das Immunsystem zunächst in Schach gehalten hatte, flammt wieder heftig auf.
„Die Bindung von Suramin zeigt uns, dass die VSGs über den Immun-Schutz hinaus noch andere, rezeptorartige Funktionen haben können, die wir nun aufklären wollen“, so der Wissenschaftler.
Johan Zeelen, Monique van Straaten, Joseph Verdi, Alexander Hempelmann, Hamidreza Hashemi, Kathryn Perez, Philip D. Jeffrey, Silvan Hälg, Natalie Wiedemar, Pascal Mäser, F. Nina Papavasiliou and C. Erec Stebbins
Structure of trypanosome coat protein VSGsur and function in suramin resistance
Nature Microbiology 2021, DOI: doi.org/10.1038/s41564-0