Um Krebserkrankungen zielgerichtet behandeln zu können, bedarf es eines möglichst exakten Wissens über den Tumor. Nur so lässt sich die erhoffte Wirkung erzielen. Gerade bei Darmkrebs ist bekannt, dass es große genetische Unterschiede gibt, die den Tumoren individueller Patienten höchst vielfältige Eigenschaften verleihen. Dazu zählt auch, ob erfolgversprechende Angriffspunkte für die Behandlung vorhanden sind, welche Wirkstoffe am besten wirken und welche Therapieresistenzen zu befürchten sind.
„Um die Tumoren individueller Patienten genauer zu untersuchen, haben Mediziner bislang darauf gesetzt, Tumorzellen zu isolieren und in Kultur zu nehmen“, sagt DKTK-Forscher Henner Farin. „Das ist jedoch nicht bei jedem Tumor erfolgreich, außerdem resultieren daraus Zelllinien, die mit dem Original-Tumor nicht mehr viel gemeinsam haben.“ Eine Aussage über die individuellen Eigenschaften eines Tumors zu machen, ist anhand solcher Zellkulturen daher schwierig.
Farin geht mit seinen Kollegen am Georg-Speyer-Haus in Frankfurt daher einen anderen Weg. Er hat ein Zellkultur-Modell etabliert, mit dem sich im Labor „Mini-Därme“ züchten lassen, so genannte Organoide. Dabei handelt es sich um dreidimensionale Zellkulturen, die in ihrer Struktur und essentiellen Funktion dem Vorbild sehr nahekommen. „Solche Organoide kommen beispielsweise in der Pharmakologie zum Einsatz, um Wirkstoffe zu testen“, erklärt Farin. „Wir nutzen sie, um die genetischen Unterschiede zwischen individuellen Tumoren detailliert zu untersuchen und herauszufinden, was das für ihre Eigenschaften bedeutet.“
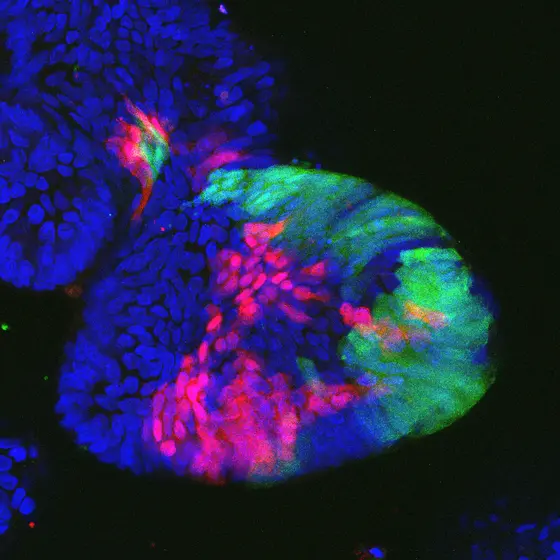
In der aktuellen Untersuchung haben die Wissenschaftler mit Hilfe der CRISPR-Cas9-Technologie in den Organoiden Tumor-Suppressorgene ausgeschaltet. Dabei handelt es sich um die „Krebsbremsen“, die normalerweise dafür sorgen, dass mutierte Zellen absterben und es gar nicht erst zur Tumorentstehung kommen kann. Ein Verlust dieser Tumor-Suppressorgene hat krebsfördernde Wirkung. Statt die Auswirkung der Krebsbremsen in aufwändigen Testreihen einzeln zu prüfen, erstellen die Wissenschaftler aus Farins Team Bibliotheken, mit deren Hilfe sich der Verlust einer ganzen Reihe von Tumor-Suppressorgenen gleichzeitig untersuchen lässt.
Dabei trägt jede Zelle einen individuellen DNA-Barcode, der parallel ausgelesen wird. So lässt sich etwa ermitteln, welche genetischen Veränderungen dazu führen, dass Krebszellen gegenüber einer Therapieform unempfindlich sind. „Der Vergleich mehrerer Tumor-Suppressorgene in einem einzelnen Ansatz erhöht den Durchsatz und stellt dabei sicher, dass alle Gene unter denselben Bedingungen und somit unvoreingenommen untersucht werden können“, so Farin.
Um die Eigenschaften der Tumor-Suppressorgene nicht nur in der Kulturschale zu untersuchen, transplantierten die Wissenschaftler ihre Organoide in einem weiteren Experiment in Mäuse. „Auf diese Weise haben wir ein Modellsystem entwickelt, das der Situation im Patienten so nahe wie möglich kommt“, erklärt Farin. Mit diesem System lässt sich überprüfen, ob der Verlust von Tumor-Suppressorgenen auch im lebenden Organismus zu einem Wachstumsvorteil für die Krebszellen führt.
„Wir haben mit den Organoiden in Kombination mit den CRISPR/Cas9-Bibliotheken eine Technologie in der Hand, mit denen wir die patientenspezifischen Tumoreigenschaften untersuchen können“, so Farin und ergänzt: „Das erlaubt uns, die individuellen Schwachstellen eines Tumors zu identifizieren, gegen die sich eine erfolgreiche Therapie richten kann.“ Damit kann das Organoid-System zu einem wichtigen Hilfsmittel für die personalisierte Medizin werden.
Birgitta E. Michels, Mohammed H. Mosa, Barbara I. Streibl, Tianzuo Zhan, Constantin Menche, Khalil Abou-El-Ardat, Tahmineh Darvishi, Ewelina Członka, Sebastian Wagner, Jan Winter, Hind Medyouf, Michael Boutros und Henner F. Farin. Pooled in vitro and in vivo CRISPR-Cas9 screening identifies tumor suppressors in human colon organoids. Cell Stem Cell 2020,
doi.org/10.1016/j.stem.2020.04.003
Ein Bild zur Meldung steht zum Download zur Verfügung:
dktk-pm.png
BU: „Mini-Därme“ (Kolon-Organoide): Die Zellregionen nach Verlust des Tumor-Suppressorgens sind rot und grün markiert.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Als Bildnachweis ist folgendes anzugeben: „Quelle: Henner Farin / DKTK“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.