Krebszellen müssen sich mit vielen Widrigkeiten herumschlagen: Ihre rasche Zellteilung führt auf die Dauer zu fehlerhaften Proteinen. Ihre Ernährungssituation und auch die Sauerstoffversorgung sind oft prekär, die Gifte einer Chemotherapie bedrohlich: Wissenschaftler sprechen in einer solchen Situation von „zellulärem Stress“. Die verschiedenen Stress-Stimuli aktivieren in der Zelle das Enzym JNK als zentralen Stress-Schalter. In Krebszellen kann dies vielfältige Auswirkungen haben, je nach Umgebung löst JNK-Aktivität zellulären Selbstmord oder aber ein Überlebensprogramm aus.
„Wir wollten genau wissen, was in Brustkrebszellen nach Aktivierung von JNK passiert“, sagt Thordur Oskarsson, Stammzell-Forscher im DKFZ und HI-STEM*. Bei dieser Untersuchung stießen er und sein Team auf einen direkten Zusammenhang zwischen JNK-Aktivierung und der Entstehung von Metastasen. Die Forscher fanden außerdem, dass auch Standard-Chemotherapien, die bei Brustkrebs gegeben werden, JNK aktivieren und dadurch die Wirksamkeit der Behandlung limitieren.
„Die Medikamente erledigen sicherlich ihren Job und töten Krebszellen ab – haben aber offensichtlich gleichzeitig auch ungünstige Effekte, die berücksichtigt werden sollten“, erklärt Oskarsson.“ Er verweist aber darauf, dass seine neuen Ergebnisse nichtsdestotrotz neue Chancen eröffnen: „Wir haben gleich drei bislang unbekannte Ansatzpunkte identifiziert, an denen neuen Wirkstoffe ansetzen könnten, um die Krebsausbreitung zu bremsen und Resistenz zu verhindern.“
Oskarsson und sein Team hatten zunächst Gewebeproben von Patientinnen mit metastasiertem Brustkrebs untersucht. Je mehr JNK-Aktivität sie im Brustkrebsgewebe nachwiesen, desto ungünstiger war der Verlauf der individuellen Erkrankung. Metastasen enthielten mehr JNK-aktive Zellen als Primärtumoren.
JNK versetzt Brustkrebszellen in Stammzell-Modus
Dies bestätigte sich auch bei Mäusen, in denen menschliche Brustkrebszellen zu metastasierenden Tumoren herangewachsen waren. Hier fanden die Forscher besonders eklatante Unterschiede zwischen den winzigen Mikrometastasen, die bis zu 50 Prozent JNK-aktive Zellen enthielten, und fortgeschrittenen Metastasen, wo JNK nur noch in etwa 15 Prozent der Zellen aktiv war. „JNK fördert Beweglichkeit und Invasivität, das ist ein typisches Verhalten aggressiver Krebszellen. Es ist für die Kolonialisierung neuer Gewebe erforderlich und wird wieder heruntergefahren, sobald die Metastase sich etabliert hat“, erklärt Jacob Insua-Rodríguez, der Erstautor der Arbeit.
Ihn interessierte nun, was in den Brustkrebszellen auf molekularer Ebene passiert, wenn JNK aktiv wird. Offenbar verfallen sie in einen Stammzell-Modus, denn das Muster ihrer Genaktivität ähnelt dem, das von Brust-Stammzellen bekannt ist. Damit verbunden ist außerdem die Produktion bestimmter Proteine der extrazellulären Matrix, SPP1 und TNC.
Stressfaktor Chemotherapie
Was passiert, wenn Brustkrebszellen dem Stressfaktor Chemotherapie ausgesetzt sind? Das untersuchte Oskarsson und Kollegen wieder an Mäusen, denen sie menschliche Brustkrebszellen übertragen hatten. Die Medikamente Paclitaxel oder Doxorubicin aktivierten die JNK in den Brustkrebszellen und lösten das Stammzell-Programm aus. In den Lungenmetastasen der Tiere stieg der Anteil JNK-aktiver Zellen drastisch an, von 20 Prozent auf 80 Prozent. Doch wenn die Wissenschaftler die Krebsmedikamente in Kombination mit einem JNK-Inhibitor gaben, bildeten sich deutlich weniger Metastasen in der Lunge der Mäuse.
Doch tatsächlich verantwortlich für das aggressive Verhalten der Brustkrebszellen sind die beiden Proteine SPP1 und TNC, die durch JNK angekurbelt werden: Erhielten die Mäuse Brustkrebszellen, bei denen SPP1 oder TNC genetisch ausgeschaltet waren, blieb die JNK-Aktivität ohne negative Konsequenzen. Wurden diese Tiere mit Chemotherapie behandelt, so war sowohl das Tumorwachstum als auch die Anzahl der Lungenmetastasen signifikant geringer als bei Mäusen, denen normale Brustkrebszellen übertragen worden waren.
SPP1 oder TNC sind Proteine der extrazellulären Matrix, die quasi die Mikroumgebung der Tumorzellen bildet. Die Forscher sehen ihre Ergebnisse daher als einen weiteren Beweis für den erheblichen Einfluss der so genannten „Nische“ auf den Verlauf einer Krebserkrankung.
„Wir wissen jetzt, dass wir die JNK als zentralen Schalter für die Aggressivität der Brustkrebszellen mit spezifischen Wirkstoffen ausschalten, damit die Produktion der beiden molekularen Hauptakteure SPP1 und TNC stoppen und so die Metastasierung drosseln können“, resümiert Oskarsson. „So können wir in Zukunft noch besser untersuchen, wodurch es zur Metastasierung und Therapieresistenz von Brustkrebs kommt – und wir haben vielversprechende neue Ansatzpunkte für die Therapieentwicklung entdeckt.“
*Das Heidelberger Institut für Stammzellforschung und experimentelle Medizin (HI-STEM) gGmbH ist eine Partnerschaft des DKFZ und der Dietmar Hopp Stiftung
Jacob Insua-Rodríguez, Maren Pein, Tsunaki Hongu, Jasmin Meier, Arnaud Descot, Camille M Lowy, Etienne De Braekeleer, Hans-Peter Sinn, Saskia Spaich, Marc Sütterlin, Andreas Schneeweiss& Thordur Oskarsson: Stress signaling in breast cancer cellsinduces matrix components that promote chemoresistant metastasis
EMBO Molecular Medicine 2018, DOI: 10.15252/emmm.201809003
Ein Bild zur Pressemitteilung steht zur Verfügung unter:
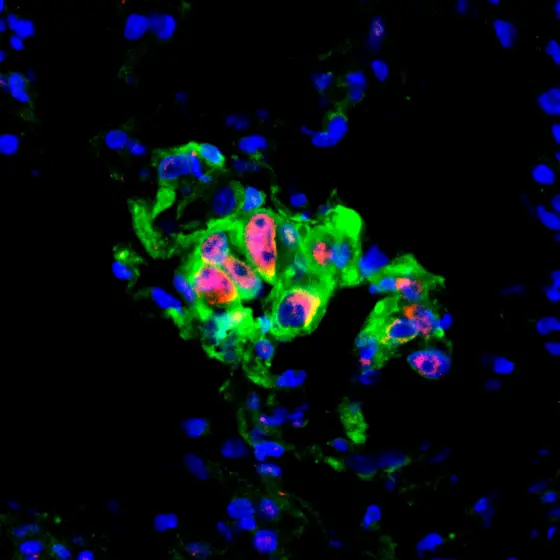
p-c-Jun-Early-Mets.jpg
BU: Lungenkrebs-Mikrometastase in der Maus: In den rot markierten Zellen ist der zentrale Stress-Schalter JNK aktiv. Krebszellen sind grün, Zellkerne blau gefärbt.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Als Bildnachweis ist folgendes anzugeben: „Quelle: Tsunaki Hongu/DKFZ“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.