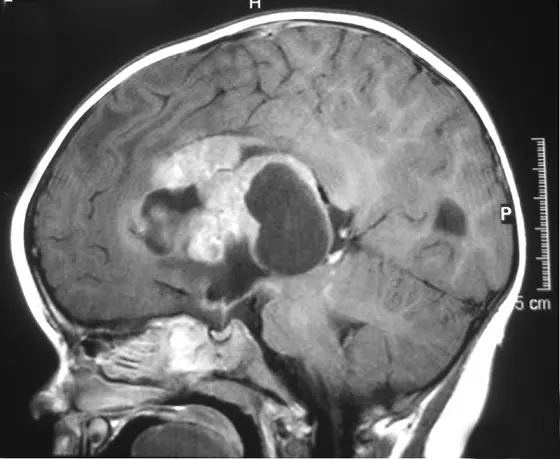
Rhabdoide Hirntumoren betreffen überwiegend sehr junge Kinder in ihren ersten drei Lebensjahren. Trotz aggressiver Therapien sind die Heilungsaussichten von Kleinkindern und Säuglingen mit dieser Krebsart äußerst ungenügend.
Die fachsprachlich als „atypisch teratoide/rhabdoider Tumoren (ATRT)“ bezeichneten Tumoren können im gesamten Gehirn auftreten. Genetische Analysen haben ergeben, dass sie so gut wie immer die gleiche Mutation aufweisen: Ihnen fehlt das Tumorsuppressorgen SMARCB1. Dieser Genverlust gilt inzwischen als diagnostisches Kriterium für Hirntumoren der ATRT-Gruppe.
„Zwar verlaufen die meisten rhabdoiden Hirntumoren sehr aggressiv. Aber es gibt doch immer wieder Ausnahmen, einige Kinder sprechen recht gut auf die Therapien an. Das ist ein Indiz für eine bislang unbekannte molekulare Heterogenität unter diesen Tumoren“, sagt Marcel Kool, Molekulargenetiker am Deutschen Krebsforschungszentrum.
Mit einer großangelegten umfassenden molekularen Analyse des Erbguts der rhabdoiden Hirntumoren suchte ein internationales Forscherteam unter der Leitung von Marcel Kool nun nach diesen molekularen Differenzen. Neben der DNA Sequenzierung konzentrierten sich die Forscher auf die epigenetischen Unterschiede und auf abweichende Genexpressionsprofile. „Eine solche Untersuchung an 192 Proben ist bei seltenen Krebsarten wie den rhabdoiden Hirntumoren nur in großen internationalen Kooperationsprojekten möglich“, erklärt der Molekulargenetiker Pascal Johann, der Erstautor der Arbeit, der gleichzeitig als Kinderarzt am Universitätsklinikum Heidelberg tätig ist.
Das Erbgut der rhabdoiden Hirntumoren erwies sich als bemerkenswert homogen, was Fehler in der DNA-Sequenz oder Umlagerungen in den Chromosomen betraf. Die Forscher fanden außer dem SMARCB1-Verlust keine weiteren häufig auftretenden Mutationen.
Die Analyse der DNA-Methylierung zeigte dagegen drei stark voneinander abweichende Gruppen auf, die mit unterschiedlicher Präferenz in bestimmten Hirnregionen auftreten. Dies deuten die Wissenschaftler als Hinweis auf einen unterschiedlichen Ursprung der Tumoren. Zwei der drei Gruppen (TYR und SHH) wiesen beispielsweise eine generelle Hypermethylierung auf. Bei der dritten Gruppe (MYC) dagegen erstrecken sich schwächer methylierte Regionen über mehr als ein Drittel des gesamten Erbguts. Diese abweichende Methylierung kann großen Einfluss auf die Expression krebsrelevanter Gene haben. So können Tumorsuppressoren stillgelegt oder aber Onkogene überaktiviert werden.
Für jede der drei Gruppen konnten die Forscher anhand epigenetischer Merkmale besonders dominante genetische Steuerelemente (Enhancer) identifizieren. Diese Steuerelemente fördern die Expression zentraler Transkriptionsfaktoren, die die Spitze der Hierarchie im Transkriptionsnetzwerk der jeweiligen Zelle darstellen und das Krebswachstum antreiben. Solche Transkriptionsfaktoren prüfen die Wissenschaftler als Zielstrukturen für zielgerichtete Medikamente. So spielt etwa MITF, ein bekanntes Onkogen beim schwarzen Hautkrebs, besonders bei den Tumoren der TYR-Gruppe eine wichtige Rolle. Ein synthetischer Wirkstoff gegen MITF trieb MITF-überexprimierende Zellen der TYR-Tumoren in den Zelltod Apoptose.
Auch was die entwicklungsgeschichtliche Abstammung der Tumoren betrifft, fanden die Forscher neue Hinweise: Die beiden maßgeblichen Transkriptionsfaktoren von rhabdoiden Hirntumoren des TYR-Typs sind auch für eine bestimmte Gruppe von Medulloblastomen essentiell. „Das könnte heißen, dass diese Medulloblastome und die rhabdoiden Hirntumoren der Tyr-Gruppe einen gemeinsamen zellulären Ursprung haben“, erklärt Marcel Kool.
„Noch können wir nicht sagen, ob die molekulare Heterogenität die Grundlage für die Unterschiede im Therapieansprechen ist, erklärt Pascal Johann. „Aber anhand unserer Ergebnisse können wir die Patienten nun sinnvoll klinischen Studien zuordnen, um gezielt neue Therapieoptionen zu überprüfen.“
Pascal D. Johann, Serap Erkek, Marc Zapatka, Kornelius Kerl, Ivo Buchhalter, Volker Hovestadt, David T.W. Jones, Dominik Sturm, Carl Hermann, Maia Segura Wang , Andrey Korshunov, Marina Rhyzova, Susanne Gröbner, Sebastian Brabetz, Lukas Chavez, Susanne Bens, Stefan Gröschel, Fabian Kratochwil, Andrea Wittmann, Laura Sieber, Christina Geörg, Stefan Wolf, Katja Beck, Florian Oyen, David Capper, Peter van Sluis, Richard Volckmann, Jan Koster, Rogier Versteeg, Andreas von Deimling, Till Milde, Olaf Witt, Andreas E. Kulozik, Martin Ebinger, Tarek Shalaby, Michael Grotzer, David Sumerauer, Josef Zamecnik, Jaume Mora, Nada Jabado, Michael D. Taylor, Annie Huang, Eleonora Aronica, Anna Bertoni, Bernhard Radlwimmer, Torsten Pietsch, Ulrich Schüller, Reinhard Schneppenheim, Paul A. Northcott, Jan O. Korbel, Reiner Siebert, Michael C. Frühwald, Peter Lichter, Roland Eils, Amar Gajjar, Martin Hasselblatt, Stefan M. Pfister, and Marcel Kool: Atypical teratoid/rhabdoid tumors (ATRT) are comprised of three epigenetic subgroups with distinct enhancer landscapes
Cancer Cell 2016, DOI: 10.1016/j.ccell.2016.02.001