Lymphdrüsenkrebs, so genannte Lymphome, sind Erkrankungen, die sich von Zellen des Immunsystems, den Lymphozyten, ableiten. Das Burkitt-Lymphom stellt die häufigste Form von Lymphomen im Kindesalter dar, tritt aber auch bei Erwachsenen auf.
Das Burkitt-Lymphom war der erste Lymphdrüsenkrebs, bei dem bereits in den 1970er Jahren eine wiederkehrende Genveränderung identifiziert wurde. Es handelt sich dabei um den Austausch von Material zwischen zwei Chromosomen, der zur Aktivierung des Krebsgens MYC führt. Allerdings reicht die Aktivierung des MYC-Gens alleine nicht aus, um die Zellen entarten zu lassen.
Aber nicht nur Genveränderungen führen zu Lymphdrüsenkrebs, sondern auch eine abnormale chemische Markierung des Erbguts: Dies zeigten Wissenschaftler des Lymphom-Projekts im Internationalen Krebsgenom-Konsortium ICGC um Prof. Reiner Siebert (Christian-Albrechts-Universität Kiel), Prof. Ralf Küppers (Universität Duisburg-Essen), Dr. Steve Hoffmann (Universität Leipzig) und Dr. Bernhard Radlwimmer sowie Prof. Peter Lichter vom Deutschen Krebsforschungszentrum in Kooperation mit Partnern vom Internationalen Epigenom-Konsortium.
Die DNA-Markierung mit Methylgruppen, ein wichtiger Mechanismus der so genannten epigenetischen Regulation, entscheidet darüber, welche Gene häufig oder selten abgelesen werden. In der jetzt publizierten Arbeit haben die Wissenschaftler und Ärzte des Verbundprojektes die DNA-Methylierungsmuster von Burkitt-Lymphomen und follikulären Lymphomen untersucht. Dieses Muster verglichen sie mit den DNA-Mutationen und der Genaktivität derselben Tumoren. „So konnten wir interpretieren, wie sich eine Änderungen in der DNA-Methylierung auswirkt“, sagt Helene Kretzmer von der Universität Leipzig, Erstautorin der Studie.
Die Untersuchungen zeigten, dass Burkitt- und follikuläre Lymphome charakteristische DNA-Methylierungsmuster tragen, die sie voneinander und auch von Zellen, aus denen beide hervor gehen, unterscheiden. Veränderte Methylierung und Mutationen von Genen in wichtigen Signalwegen schlossen einander oftmals aus. Das heißt, in Patienten mit Genmutation war meist keine Methylierungsveränderung zu finden, und umgekehrt.
„Diese einander ergänzenden Muster zweier unterschiedlicher tumorspezifischer Veränderung unterstreichen die besondere Bedeutung der betroffenen Signalwege in Lymphomen.“ sagt Bernhard Radlwimmer vom Deutschen Krebsforschungszentrum.
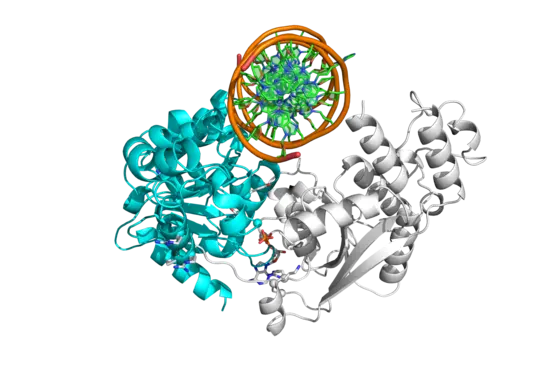
Bei ihren Analysen konnten die Forscher einen sowohl durch epigenetische als auch genetische Mechanismen stark regulierten Signalweg identifizieren, der das SMARCA4 Gen in Burkitt-Lymhomen aktiviert. SMARCA4 ist ein Teil eines Protein-Komplexes, der die Aktivität ganzer Genregionen reguliert.
Besonders in Burkitt-Lymphomen ist das SMARCA4 Gen allerdings häufig von Mutationen betroffen, die verhindern, dass der regulierende Proteinkomplex korrekt funktioniert. „Die Kombination von gesteigerter Genaktivität und Funktionsänderung des SMARCA4 Proteins trägt wahrscheinlich wesentlich zur Entwicklung des Burkitt Lymphoms bei. Zukünftige Untersuchungen müssen zeigen, ob uns das möglicherweise einen neuen Ansatz bietet, den Lymphdrüsenkrebs zu behandeln“, sagt Reiner Siebert, der Koordinator des Lymphom-Projekts im Internationalen Krebsgenom-Konsortium.
Der Lymphom-Forschungsverbund ist Teil des Internationalen Krebs-Genomkonsortiums (International Cancer Genome Consortium, ICGC). Ziel dieses weltweiten Projekts ist die umfassende Beschreibung von genetischen und epigenetischen Veränderungen in den 50 bedeutendsten Krebsarten. Dies soll die Grundlage zur Entwicklung neuer diagnostischer Ansätze und Therapiestrategien schaffen. Die beiden anderen deutschen ICGC Projekte werden vom Deutschen Krebsforschungszentrum koordiniert. Hier werden zum einen kindliche Hirntumoren, zum anderen Prostatakrebs bei jüngeren Männern analysiert.
Die Arbeiten der deutschen ICGC Projekte werden vom Bundesministerium für Bildung und Forschung (BMBF) sowie von der Deutschen Krebshilfe gefördert.
Helene Kretzmer, Stephan H. Bernhart, Wei Wang, Andrea Haake, Marc A. Weniger, Anke K. Bergmann, Matthew J. Betts, Enrique Carrillo-de-Santa-Pau, Gero Doose, Jana Gutwein, Julia Richter, Volker Hovestadt, Bingding Huang, Daniel Rico, Frank Jühling, Julia Kolarova, Qianhao Lu, Christian Otto, Rabea Wagener, Judith Arnolds, Birgit Burkhardt, Alexander Claviez, Hans G. Drexler, Sonja Eberth, Roland Eils, Paul Flicek, Siegfried Haas, Michael Hummel, Dennis Karsch, Hinrik H.D. Kerstens, Wolfram Klapper, Markus Kreuz, Chris Lawerenz, Dido Lenze, Markus Loeffler, Cristina López, Roderick A.F. MacLeod, Joost H.A. Martens, Marta Kulis, José Ignacio Martín-Subero, Peter Möller, Inga Nagel, Simone Picelli, Inga Vater, Marius Rohde, Philip Rosenstiel, Maciej Rosolowski, Robert B. Russell, Markus Schilhabel, Matthias Schlesner, Peter F. Stadler, Monika Szczepanowski, Lorenz Trümper, Hendrik G. Stunnenberg, Ralf Küppers, Ole Ammerpohl, Peter Lichter, Reiner Siebert, Steve Hoffmann, Bernhard Radlwimmer: DNA-methylome analysis in Burkitt and follicular lymphomas identifies differentially methylated regions linked to somatic mutation and transcriptional control.
Nature Genetics 2015, DOI: 10.1038/ng.3413