Die Analyse des Tumorerbguts ist eine wichtige Informationsquelle für Ärzte und Wissenschaftler, um Zellveränderungen zu entdecken, die die Krebsentstehung fördern oder das Krebswachstum ankurbeln. Bei der Erbgutanalyse stoßen die Forscher immer wieder auf Veränderungen, deren Bedeutung für die Funktionen der Zelle sie nicht genau kennen. „Wenn wir vermuten, dass eine bestimmte Mutation krebsfördernd wirkt, so müssen wir das letztendlich am lebenden Organismus beweisen“, sagt Dr. Jan Gronych vom Deutschen Krebsforschungszentrum.
Solche Nachweise sind häufig sehr zeit- und arbeitsaufwändig: In der Regel müssen Mäuse gezüchtet werden, die die Mutation im Erbgut aller Zellen tragen. An diesen Tieren wird dann die Tumorentstehung untersucht. „Solche Experimente können Jahre in Anspruch nehmen“, erklärt Gronych. Besonders aufwändig nachzuweisen ist die Auswirkung von Mutationen der „Krebsbremsen“, der so genannten Tumorsuppressor-Gene:
Ein neues Verfahren, das seit wenigen Jahren die Gentechnik revolutioniert, ist die CRISPR/Cas9-Technik, mit der Gene gezielt ausgeschaltet werden können. Dabei nutzen die Wissenschaftler RNA-Sonden, die ein Enzym gezielt an das zu untersuchende Gen leiten, das dann von dem Enzym zerstört wird.
Jan Gronych und seine Kollegen Marc Zuckermann und Dr. Daisuke Kawauchi hofften, mit dieser Methode einfacher untersuchen zu können, welche Folgen der Ausfall bestimmter Tumorsuppressor-Gene tatsächlich hat. Es gelang ihnen nun, im Gehirn von Mäusen einzelne Krebsbremsen mit der CRISPR/Cas9-Methode gezielt zu zerstören und die daraufhin entstehenden Hirntumoren zu untersuchen.
Verlust der Krebsbremsen führt zu Glioblastom und Medulloblastom
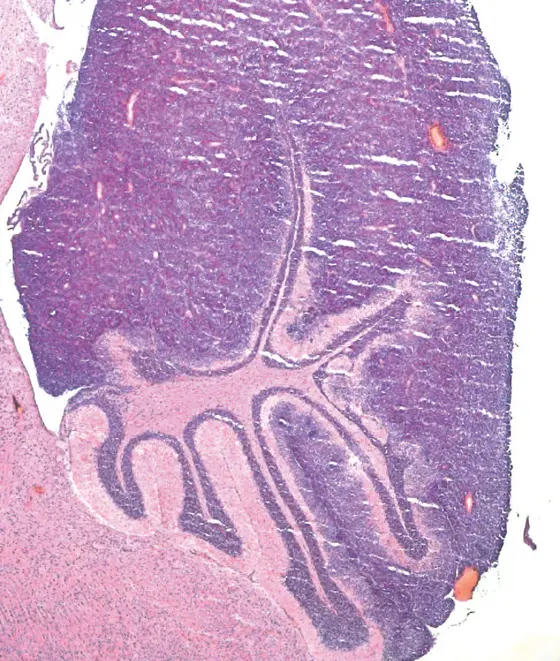
Die Forscher wählten als Modell zwei verschiedene Krebsarten, deren molekulare Ursachen bekannt sind. Mutationen, die das Tumorsuppressor-Gen Ptch1 in Zellen des Kleinhirns zerstören, führen bei Mäusen und Menschen sehr häufig zu einer bestimmten Form von Medulloblastomen. In einem zweiten, komplexeren Ansatz zielten die Forscher mit den CRISPR/Cas9-Konstrukten auf drei bekannte Tumorsuppressor-Gene (P53, PTEN und NF1) zugleich. Der gleichzeitige Ausfall dieser drei Krebsbremsen wurde häufig bei Glioblastomen beobachtet. Die Wissenschaftler brachten die CRISPR/Cas9-Konstrukte direkt ins Gehirn von Mäusen ein.
Die so behandelten Mäuse entwickelten tatsächlich Medulloblastome bzw. Glioblastome, abhängig von der verwendeten Technik in unterschiedlicher Häufigkeit. Die Tumoren ähnelten in ihrer Gewebestruktur den menschlichen Erkrankungen. Sequenzierung der Tumorgenome bestätigte in allen Fällen, dass die CRISPR/Cas9-Methode die anvisierten Suppressor-Gene zuverlässig eliminiert hatte. Wiederholte DNA-Schäden außerhalb der eigentlichen Zielsequenzen, die bei der CRISPR/Cas9-Methode häufig beschrieben worden sind, beobachteten die Forscher dagegen nicht.
„Die weltweiten Analysen von Tumorgenomen schaffen eine wahre Flut an Daten. Damit muss die biologische Funktionsprüfung der entdeckten Mutationen Schritt halten“, sagt Jan Gronych. „Die vielfältig einsetzbare CRISPR/Cas9-Technik kann in Zukunft dabei helfen, die Auswirkungen neu identifizierter Mutationen auf die Krebsentstehung deutlich schneller zu überprüfen.“
Marc Zuckermann, Volker Hovestadt, Christiane B. Knobbe-Thomsen, Marc Zapatka, Paul A. Northcott, Kathrin Schramm, Jelena Belic, David T.W. Jones, Barbara Tschida, Branden Moriarity, David Largaespada, Martine F. Roussel, Andrey Korshunov, Guido Reifenberger, Stefan M. Pfister, Peter Lichter, Daisuke Kawauchi & Jan Gronych: Somatic CRISPR/Cas9-mediated tumour suppressor disruption enables versatile brain tumour modelling
Nature Communications 2015, DOI: 10.1038/ncomms8391