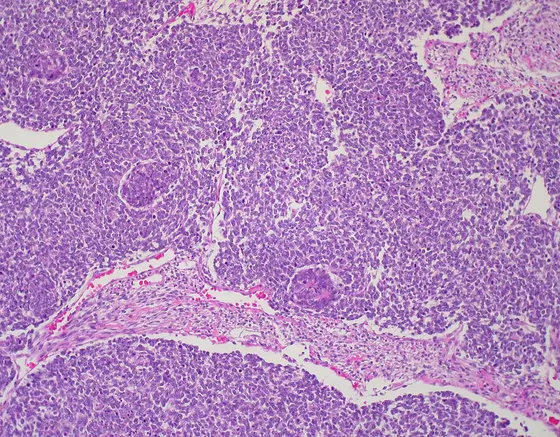
Wilms-Tumoren, auch als Nephroblastome bezeichnet, gehören zu den häufigen soliden Tumoren im Kindesalter. Sie treten zumeist vor dem sechsten Lebensjahr auf und zählen zur Kategorie der sogenannten embryonalen Tumoren. Ausgangspunkt ihrer Entwicklung sind Nierenvorläuferzellen des Embryos, die offenbar nicht korrekt ausreifen. Im Tumor finden sich daher teilweise unterschiedliche Gewebestrukturen, weshalb ihr Namensgeber Max Wilms in seiner Beschreibung 1899 von „Mischgeschwülsten der Niere“ sprach.
Bei der Suche nach den molekularen Ursachen von Wilms-Tumoren und vor allem von deren Hochrisiko-Varianten ist jetzt einem Wissenschaftlerteam ein Durchbruch gelungen. Daran beteiligt waren die Arbeitsgruppen von Professor Manfred Gessler, Inhaber des Lehrstuhls für Entwicklungsbiochemie am Biozentrum der Universität Würzburg, und die Arbeitsgruppen von Marcel Kool und Stefan Pfister am Deutschen Krebsforschungszentrum Heidelberg mit Kooperationspartnern im In- und Ausland. In der aktuellen Ausgabe der Fachzeitschrift Cancer Cell stellen sie ihre Ergebnisse vor.
Gendefekte bremsen die molekulare Maschinerie
„Bislang waren drei Gene als mögliche Auslöser von Wilms-Tumoren bekannt. Wir konnten jetzt eine ganze Reihe weiterer Ursachen identifizieren“, erklärt Manfred Gessler. Da sind zum einen die Gene DROSHA und DGCR8. Sind diese defekt, kommt es zu einer teilweisen Inaktivierung der molekularen Maschinerie, die für die Bildung sogenannter microRNAs verantwortlich ist. MicroRNAs wiederum können die Funktion einer Vielzahl von Boten-RNA-Molekülen regulieren und somit Zellen komplett umprogrammieren.
„Von embryonalen Stammzellen weiß man bereits, dass diese ohne microRNAs nicht in der Lage sind, sich in Zellen verschiedener Gewebe umzuwandeln“, sagt Gessler. Genau dies scheint auch bei Wilms-Tumoren der Fall zu sein: Bei ihnen schaffen es einzelne Nierenvorläuferzellen offenbar nicht, komplett auszureifen. Sie verharren vielmehr in einem embryonalen Zustand, in dem rasches Wachstum zu ihren elementaren Aufgaben gehört, um die Niere wachsen zu lassen.
Ein Gendefekt löst verschiedene Krebsarten aus
Neben den microRNAs rückten auch zwei Transkriptionsfaktoren ins Zentrum des Interesses der Arbeitsgruppen. Die als SIX1 und SIX2 bezeichneten Proteine steuern die Aktivität anderer Gene; aus Tiermodellen war bereits bekannt, dass sie für die Bildung der Nieren absolut unerlässlich sind, zudem sind sie in Wilms-Tumoren besonders aktiv. „Unsere Ergebnisse zeigen nun erstmals, dass die beiden Gene für diese Transkriptionsfaktoren in Wilms-Tumoren durch Mutationen verändert sind und dadurch auch in diesem Fall die Zellen in einem embryonalen Wachstumsmodus verharren“, erklärt Gessler.
Drittes Ergebnis der Studie: Tumorgene, die als Auslöser anderer Krebsarten bekannt sind, können auch zu Wilms-Tumoren führen. So konnten die Wissenschaftler zeigen, dass ein bestimmtes Gen, das an der Entwicklung von Neuroblastomen beteiligt ist – auch in Wilms-Tumoren aktiviert ist. „Das gibt Anlass zur Hoffnung, dass Therapien, die bei einem Neuroblastom erfolgreich sind, auch gegen Wilms-Tumoren wirksam sein könnten“, sagt Gessler.
Weiterhin zeigte ein Teil der Wilms-Tumoren eine Inaktivierung des bekanntesten Tumorsuppressor-Gens TP53, was zu dramatischen Genomveränderungen mit Zerbrechen und unkontrolliertem Verlust oder Vermehrung von Chromosomenbruchstücken einherging. Die Prognose solchermaßen entarteter Tumoren ist besonders ungünstig.
Ansätze für eine personalisierte Therapie
Die neuen Erkenntnisse über die unterschiedlichen Auslöser von Wilms-Tumoren können nach Ansicht der beteiligten Wissenschaftler dazu beitragen, die Therapie zu verbessern. Derzeit überleben rund 90 Prozent der erkrankten Kinder, wenn sie eine Kombination aus Chemotherapie, Operation und anschließender erneuter Chemotherapie erhalten. Die große Kunst dabei ist es, Patienten mit sogenannten Hochrisiko-Tumoren frühzeitig zu erkennen und intensiver zu behandeln als Fälle mit erkennbar geringem Rückfallrisiko. Auf diese Weise sollen die Belastungen und mögliche Folgeschäden für die Kinder so niedrig wie möglich gehalten werden.
Eine feingewebliche Untersuchung, wie sie heute routinemäßig zum Einsatz kommt, und der klinische Befund liefern dafür schon wichtige Hinweise. Diese reichen aber noch nicht aus. „Durch die Aufklärung der molekularen Ursachen besteht die Hoffnung, die Klassifikation der Tumoren zu verbessern, und im Rahmen einer personalisierten Medizin auch vermehrt zielgerichtete Therapien einsetzen zu können“, sagt Manfred Gessler.
Allerdings ist bei einigen dieser jetzt entdeckten genetischen Veränderungen noch unklar, wie sie zur Tumorentstehung beitragen. Das Ziel der zukünftigen Arbeiten wird es vor allem sein, aus der Fülle an Kandidaten diejenigen herauszufiltern, die am besten geeignet sind, den Verlauf der Erkrankung vorherzusagen, und auf dem neuen Wissen um die molekularen Netzwerke Ansätze für maßgeschneiderte Therapien zu entwickeln.
Ideale Kombination unterschiedlicher Expertisen
Für die Untersuchung der Wilms-Tumoren haben sich die Expertisen der beteiligten Arbeitsgruppen ideal ergänzt: Die Würzburger Gruppe konnte jahrzehntelange Erfahrung in der Analyse von Wilms-Tumoren und eine der weltweit größten Sammlungen dieser Tumoren beisteuern, die am Biozentrum beheimatet ist. Die Heidelberger Arbeitsgruppe am Deutschen Krebsforschungszentrum konnte umfangreiche Kapazitäten und Erfahrung in der Hochdurchsatzsequenzierung und Genomanalyse einbringen. Die dabei entdeckten Veränderungen wurden wiederum in Würzburg an Hunderten weiterer Tumoren überprüft und auf ihre Funktion hin untersucht.
Für die weiteren Arbeiten wird die enge Zusammenarbeit mit vielen Kinderkliniken und Pathologen im Rahmen der Deutschen Wilms-Tumor-Studie und mit europäischer Partnern essentiell sein, denn nur so können ausreichend Material und Daten solcher Tumoren erfolgreich gesammelt und analysiert werden.
Diese Arbeiten wurden unterstützt durch die Wilhelm-Sander-Stiftung, die Deutsche Forschungsgemeinschaft, das Bundesministerium für Bildung und Forschung und die HIPO Initiative des Deutschen Krebsforschungszentrums (DKFZ-HIPO).
Mutations in the SIX1/2 Pathway and the DROSHA/DGCR8 miRNA Microprocessor Complex Underlie High-Risk Blastemal Type Wilms Tumors. Jenny Wegert, Naveed Ishaque, Romina Vardapour, Christina Geörg, Zuguang Gu, Matthias Bieg, Barbara Ziegler, Sabrina Bausenwein, Nasenien Nourkami, Nicole Ludwig, Andreas Keller, Clemens Grimm, Susanne Kneitz, Richard D. Williams, Tas Chagtai, Kathy Pritchard-Jones, Peter van Sluis, Richard Volckmann, Jan Koster, Rogier Versteeg, Tomas Acha, Maureen J. O’Sullivan, Peter Karl Bode, Felix Niggli, Godelieve A. Tytgat, Harm van Tinteren, Marry M. van den Heuvel-Eibrink, Eckart Meese, Christian Vokuhl, Ivo Leuschner, Norbert Graf, Roland Eils, Stefan M. Pfister, Marcel Kool, Manfred Gessler. Cancer Cell 2015, http://dx.doi.org/10.1016/j.ccell.2015.01.002