Einzelne Krebszellen, die sich vom Tumor abgelöst haben und in der Blutbahn zirkulieren, gelten als verantwortlich für die Entstehung von Metastasen. Diese gefürchteten Absiedlungen des Tumors sind Hauptursache für die Krebssterblichkeit. Lassen sich im Blut eines Krebspatienten zirkulierende Tumorzellen (engl.: circulating tumor cells; CTCs) nachweisen, ist dies zwar mit einer schlechteren Prognose verbunden – trotzdem fehlte der experimentelle Beweis, ob sich unter den CTCs im wahrsten Sinne des Wortes die „Keimzellen“ der Metastasen befinden.
„Wir waren davon überzeugt, dass unter den verschiedenen zirkulierenden Tumorzellen nur einige wenige in der Lage sind, eine neue Tochtergeschwulst in einem anderen Organ zu bilden. Denn viele Patienten entwickeln keine Metastasen, obwohl Krebszellen in ihrem Blut zirkulieren“, sagt Prof. Andreas Trumpp. Der Stammzellexperte leitet im Deutschen Krebsforschungszentrum die Abteilung für Krebs und Stammzellen und darüber hinaus das Heidelberger Institut für Stammzelltechnologie und Experimentelle Medizin (HI-STEM) im DKFZ. „Die Metastasierung ist ein komplexer Prozess und Krebszellen brauchen ganz bestimmte Fähigkeiten dazu. Unsere Hypothese war, dass die Eigenschaften der Krebs-Stammzellen, die therapieresistent und sehr mobil sind, am besten dazu passen“, so Andreas Trumpp.
Um die Metastasen-initiierenden Zellen experimentell nachzuweisen, entwickelte Irène Baccelli aus Trumpps Team einen Transplantationstest. In Zusammenarbeit mit Prof. Andreas Schneeweiss am Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg sowie mit Kollegen vom Institut für Tumorbiologie in Hamburg und dem Pathologischen Institut des Universitätsklinikums Heidelberg analysierten die Forscher das Blut von mehr als 350 Brustkrebspatientinnen. Anhand bestimmter Oberflächenmoleküle isolierte Baccelli zirkulierende Tumorzellen aus dem Blut und transplantierte diese direkt ins Knochenmark von Mäusen mit defektem Immunsystem. „Das Knochenmark bietet den Krebszellen eine ideale Nische, um sich anzusiedeln“, erklärt Trumpp. Nach insgesamt mehr als hundert solcher Übertragungen entwickelten tatsächlich einige der Tiere Metastasen in Knochen, Lunge und Leber.
Damit war bewiesen, dass die CTCs Keimzellen der Metastasen enthalten – wenn auch offenbar nur in geringer Frequenz. Was aber zeichnet diese Zellen aus? Um ihre molekularen Eigenschaften zu charakterisieren, analysierten die Forscher die Oberflächenmoleküle der CTCs, bei denen die Zelltransplantation zu Metastasen geführt hatte.
Drei Moleküle kennzeichnen die Metastasen-Stammzelle
In einer systematischen Fahndungsaktion isolierte Baccelli aus den CTCs zunächst Zellen, die ein typisches Eiweiß für Brustkrebs-Stammzellen auf ihrer Oberfläche tragen (CD44). Das Protein hilft der Zelle, sich im Knochenmark festzusetzen. Diese Zellpopulation wurde wiederum nach bestimmten Oberflächenmarkern durchkämmt, die den Zellen beim Überleben in fremdem Gewebe helfen. Dazu zählt beispielsweise ein Signalmolekül, das vor Angriffen des Immunsystems schützt (CD47) sowie einen Oberflächenrezeptor, der die Wanderbereitschaft und Invasionsfähigkeit der Zellen steigert (MET).
Mit einem speziellen Gerät, dem Zellsorter, konnten die Forscher anschließend solche CTCs isolieren, die alle drei Merkmale (CD44, CD47, MET) zugleich aufwiesen. Dass es sich bei ihnen tatsächlich um die Keimzellen der Metastasen handelt, bewies ein erneuter Durchgang im Transplantationstest.
Je nach Patientin machten Zellen, die alle drei Oberflächenmoleküle ausbilden („dreifach-positiv“), zwischen 0.6 und 33 Prozent der gesamten CTCs aus. „Interessanterweise tragen ausschließlich CTCs mit dem Stammzellmarker CD44 die Kombination der beiden anderen Oberflächenmoleküle“, sagt Irène Baccelli. „Es sieht daher so aus, als handle es sich bei den dreifach-positiven Zellen um eine spezialisierte Untergruppe der Brustkrebs-Stammzellen, die im Blut zirkulieren.“
Dreifach positive Zellen als prognostischer Biomarker
Sind die dreifach-positiven Zellen ein präziserer Biomarker für den Verlauf der Brustkrebserkrankungen als die Anzahl der CTCs allein? Beim Fortschreiten der Erkrankung, so beobachteten die Forscher an einer kleinen Gruppe von Patientinnen, steigt die Anzahl der dreifach-positiven Zellen an, nicht jedoch die Gesamtzahl der CTCs. Patientinnen mit einer besonders hohen Zahl an dreifach-positiven Zellen hatten darüber hinaus besonders viele Metastasen und eine sehr viel ungünstigere Prognose als Frauen, bei denen nur wenige dieser Metastasen-induzierenden Zellen nachgewiesen wurden. „Insgesamt haben die dreifach-positiven Zellen wohl eine wesentlich höhere biologische Relevanz für das Fortschreiten der Erkrankung als die bisher untersuchten CTCs “, erklärt Andreas Schneeweiss. Diese neuen Ergebnisse sollen nun in einer großen Studie bestätigt werden.
Dass ausgerechnet die beiden Proteine CD47 und MET Metastasen-induzierende Zellen kennzeichnen, ist für Andreas Trumpp eine gute Nachricht: Gegen CD47 werden bereits therapeutische Antikörper entwickelt, die die Funktion des Moleküls blockieren. Eine Substanz, die die Aktivität des MET-Rezeptors hemmt, ist bereits zugelassen und zeigt gute Wirkung bei einer bestimmten Form von Lungenkrebs. Der Wirkstoff kann möglicherweise auch Brustkrebspatientinnen helfen, bei denen die Metastasen-induzierenden Zellen nachgewiesen wurden. „Wir haben mit den dreifach-positiven Zellen nicht nur einen vielversprechenden Biomarker für den Verlauf von metastasierendem Brustkrebs gefunden, sondern damit gleichzeitig auch neue mögliche therapeutische Ansätze für fortgeschrittenen Brustkrebs aufgezeigt“, freut sich Andreas Trumpp.
Irène Baccelli, Andreas Schneeweiss, Sabine Riethdorf, Albrecht Stenzinger, Anja Schillert, Vanessa Vogel, Corinna Klein, Massimo Saini, Tobias Bäuerle, Markus Wallwiener, Tim Holland-Letz, Thomas Höfner, Martin Sprick, Martina Scharpff, Frederik Marmé, Hans Peter Sinn, Klaus Pantel, Wilko Weichert und Andreas Trumpp: Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nature Biotechnology 2013, DOI: 10.1038/nbt.2576
Ein Bild zur Pressemitteilung steht im Internet zur Verfügung unter
ctc-induced-bone-xenograft.jpg
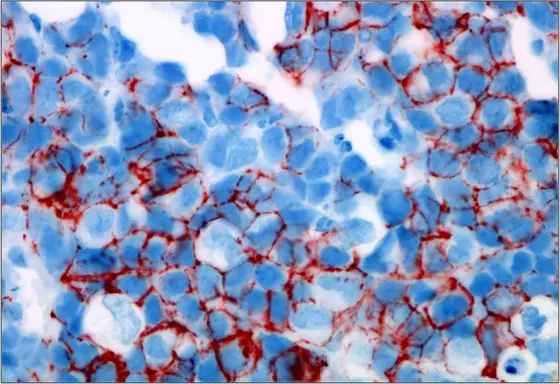
BU: Aus dem Blut von Brustkrebspatientinnen isolierte zirkulierende Tumorzellen bilden eine Metastase im Knochenmark der Mäuse. Der Stammzell-Marker CD44 ist rot gefärbt.
Quelle: Irène Baccelli, DKFZ