Beim Darmkrebs sind zwei Gene besonders häufig mutiert, die als KRAS und BRAF bezeichnet werden. Die genetischen Veränderungen in KRAS oder BRAF aktivieren in beiden Fällen denselben Signalweg. Als Reaktion auf diese Signale beginnen die Zellen, sich unkontrolliert zu teilen.
Bislang gingen die Mediziner davon aus, dass die Veränderungen in diesen beiden Genen zu ähnlichen Wachstumssignalen in allen Krebszellen führen. Diese Annahme scheint jedoch falsch zu sein, wie die Wissenschaftler um Markus Morkel und Nils Blüthgen vom Deutschen Krebskonsortium (DKTK) an der Charité – Universitätsmedizin Berlin nun im Detail untersucht haben.
„Wir waren überrascht, dass Mutationen im KRAS-Gen beim Darmkrebs nur in einem Teil der Krebszellen eine Zellantwort auslösten, in anderen jedoch nicht. Der Unterschied scheint in der Zelldifferenzierung zu liegen, das heißt, im Bestreben der Krebszelle, zu einem bestimmten Zelltyp auszureifen. Das mutierte BRAF-Gen hingegen aktivierte die Wachstumssignale in allen Zellzuständen“, fasst Morkel die wesentliche Entdeckung der Studie zusammen. Der KRAS- Signalweg spielt eine wichtige Rolle für die Zellteilung und ist daher ein zentraler Ansatzpunkt für die zielgerichtete Therapie von Darmkrebs.
Für Tumoren mit verändertem KRAS – dies betrifft fast die Hälfte aller Darmkrebsfälle in Deutschland – gibt es bisher noch keine gezielte Therapieoption. Die neuen Studienergebnisse sind daher sehr wichtig, um langfristig die Behandlung von Darmkrebs zu optimieren. Da beim Darmkrebs mit mutiertem KRAS jeweils nur ein Teil der Zellen veränderte Wachstumssignale weiterleitet, bleibt der Tumor insgesamt sehr heterogen. Das macht ihn für Therapien sehr schwer zugänglich.
„Unsere Ergebnisse legen nahe, dass Therapien zukünftig kombiniert werden müssen, um die Darmkrebszellen zunächst zu synchronisieren, also in einen einheitlichen Zustand zu bringen. Neben der grundlagenwissenschaftlichen Bedeutung könnte diese Entdeckung auch klinisch relevant sein, da unsere Untersuchungen helfen können, zukünftige zielgerichtete Kombinationstherapien zu entwickeln“, ordnet Blüthgen die Bedeutung der Studiendaten ein.
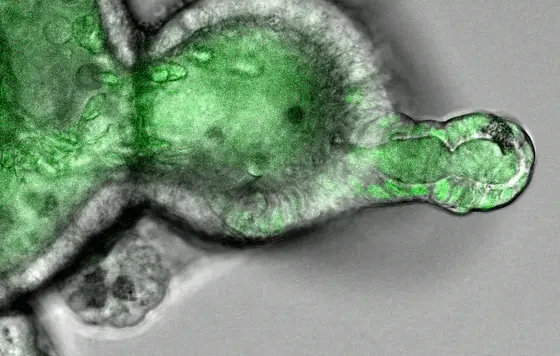
Möglich machte diese Ergebnisse die Einzelzellanalyse. Mit deren Hilfe sind Wissenschaftler heute in der Lage, Unterschiede zwischen Tausenden einzelner Zellen eines Gewebes, wie z. B. des Darmgewebes, gezielt zu erforschen. Darüber hinaus nutzten Morkel und Kollegen die sogenannte Organoid-Technologie. Das Besondere daran: Aus Operationsmaterial gewonnene Zellen des Krebsgewebes wachsen im Labor zu dreidimensionalen Strukturen heran. Zusätzlich setzten die Forscher Computersimulationen ein, um zu verstehen, an welcher Stelle die Signalverarbeitung von der Zelle selbst blockiert werden kann. Die Krebszelle ist laut der Studienergebnisse in der Lage, die Informationskette für die unkontrollierte Zellteilung an bestimmten Punkten an- oder auszuschalten. Dies erklärt auch die häufige Beobachtung, dass bestimmte Signalwege innerhalb eines Darmtumors eben nicht in allen, sondern lediglich in einem Teil der Krebszellen aktiv sind – und das hat wiederum Auswirkungen auf die Behandelbarkeit der Tumoren.
Raphael Brandt, Thomas Sell, Mareen Lüthen, Florian Uhlitz, Bertram Klinger, Pamela Riemer, Claudia Giesecke-Thiel, Silvia Schulze, Ismail Amr El-Shimy, Desiree Kunkel, Beatrix Fauler5, Thorsten Mielke, Norbert Mages, Bernhard G. Herrmann, Christine Sers, Nils Blüthgen & Markus Morkel: Cell type-dependent differential activation of ERK by oncogenic KRAS in colon cancer and intestinal epithelium.
Nature Communications 2019; doi.org/10.1038/s41467-019-10954-y
Ein Bild zur Meldung steht zur Verfügung unter:
darmepithel-kultur.jpg
Quelle: Markus Morkel / Charité – Universitätsmedizin Berlin
BU: Ein Darm-Organoid wächst in einer dreidimensionalen Matrix und zeigt ein krebsauslösendes Wachstumssignal (ERK) als grüne Fluoreszenz im Zellkern. Die Zellkerne von Kryptenzellen (rechts) zeigen hohe Aktivität, während differenzierte Epithelzellen (links) niedrige Aktivität aufweisen.
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Bitte geben Sie als Bildnachweis an: „Quelle: Markus Morkel / Charité – Universitätsmedizin Berlin“.
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.