Verbesserte Behandlung von Hirntumoren
Wissenschaftler aus dem Deutschen Krebsforschungszentrum und dem Universitätsklinikum Heidelberg erprobten beim Glioblastom eine Kombination aus Bestrahlung und einem Wirkstoff gegen den Wachstumsfaktor TGF-β. Bei Mäusen verlangsamt die Kombinationstherapie das Wachstum der bösartigen Hirntumoren wirksamer, die Tiere überleben länger. In einer multizentrischen klinischen Studie wird nun geprüft, ob auch Patienten von der Kombination aus Bestrahlung, Chemotherapie und Wachstumsfaktor-Blockade profitieren.
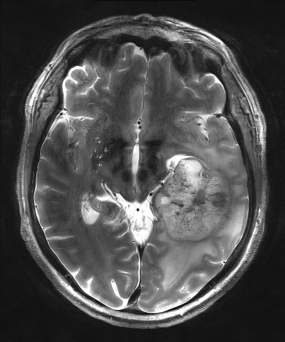
Magnetresonanztomographische Aufnahmen eines Glioblastoms
© Dr. Alexander Radbruch, Lars Gerigk, Abt. Radiologie, Deutsches Krebsforschungszentrum
Glioblastome gelten als die bösartigsten unter den Hirntumoren. Oft gelingt es den Neurochirurgen nicht, den Tumor vollständig zu entfernen. Es bestünde sonst die Gefahr, zu viel Gehirngewebe zu zerstören. Zudem ist es häufig unmöglich, während der Operation alle feinen Ausläufer zu erkennen, mit denen der Tumor in umgebendes gesundes Gewebe einwächst. Um das Wachstum der im Kopf verbliebenen Tumorzellen zumindest zu verlangsamen, werden daher so gut wie alle Glioblastom-Patienten nach ihrer Operation bestrahlt.
„Leider erreichen wir damit aber nur einen Wachstumsaufschub und keine wirkliche Heilung. Die Tumorzellen, insbesondere die Krebsstammzellen, sind sehr strahlenresistent“, erklärt Prof. Dr. Dr. Peter Huber, der im Deutschen Krebsforschungszentrum die Klinische Kooperationseinheit Strahlentherapie leitet.
Untersuchungen hatten gezeigt, dass Strahlentherapien bei verschiedenen Krebserkrankungen besser wirken, wenn gleichzeitig bestimmte zelluläre Wachstumsfaktoren blockiert werden. Zellen des Glioblastoms produzieren häufig große Mengen des Wachstumsfaktors TGF-β („transforming growth factor beta“). Ein hoher TGF-β-Spiegel in diesen Tumoren geht mit besonders aggressivem Wachstum und schlechter Prognose einher. Außerdem scheint der Faktor die Selbsterneuerungsfähigkeit der Glioblastom-Stammzellen aufrechtzuerhalten. „Wir vermuteten daher, dass eine Blockade der TGF-β -Signalwege die Selbsterneuerungsfähigkeit der Krebsstammzellen bremst und damit den Erfolg einer Strahlentherapie verbessern kann“, erklärt Peter Huber den Hintergrund der nun veröffentlichten Studie.
Gemeinsam mit Kollegen unter anderem aus der Radiologischen Universitätsklinik Heidelberg und aus der Abteilung von Prof. Dr. Ana Martin-Villalba (ebenfalls DKFZ) untersuchte Hubers Team den Effekt einer Kombination aus Bestrahlung und dem neu entwickelten Wirkstoff LY2109761. Die Substanz blockiert die Signale, die der Rezeptor des Wachstumsfaktors TGF-β in die Zellen weiterleitet. Untersucht wurden zunächst Glioblastomzellen aus Gewebeproben, die bei der chirurgischen Entfernung der Tumoren entnommen worden waren. Bestrahlung bei gleichzeitiger Zugabe des Wirkstoffes reduzierte die Selbsterneuerungsfähigkeit der Tumorstammzellen und verzögerte ihr Wachstum deutlich stärker als Strahlenbehandlung allein.
Mäuse, denen menschliche Glioblastomzellen ins Gehirn transplantiert worden waren, überlebten nach der Kombinationstherapie länger als Tiere, die nur die Bestrahlung erhielten. Die Gewebeuntersuchung zeigte, dass unter der Kombinationstherapie Tumoren langsamer und weniger invasiv wuchsen und eine geringere Dichte an neugebildeten Blutgefäßen aufwiesen. „Paradoxerweise kann die Strahlentherapie in überlebenden Tumorzellen ein bösartigeres Wachstumsverhalten provozieren. LY2109761 scheint diesen fatalen Effekt zu verhindern“, deutet Peter Huber die Wirkungsweise des Medikaments.
Die Blockade der TGF-β -Signale war so vielversprechend, dass nun in einer multizentrischen klinischen Studie untersucht wird, ob dieses Wirkprinzip auch bei Patienten das Wachstum von Glioblastomen wirkungsvoller verlangsamt als die derzeitige Standardtherapie. Unter der Federführung von Prof. Dr. Wolfgang Wick, der eine Kooperationseinheit des DKFZ und der Heidelberger Neurologischen Universitätsklinik leitet, wird die Kombinationsbehandlung in Heidelberg, in Spanien und in den USA geprüft.
Mengxian Zhang, Susanne Kleber, Manuel Röhrich, Carmen Timke, Na Han, Jochen Tuettenberg, Ana Martin-Villalba, Jürgen Debus, Peter Peschke, Ute Wirkner, Michael Lahn und Peter E. Huber: Blockade of TGF-beta signaling by the TGFβR-I kinase Inhibitor LY2109761 enhances radiation response and prolongs survival in glioblastoma. Cancer Research 2011, DOI:10.1158/0008-5472.CAN-11-1212
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Beim Krebsinformationsdienst (KID) des DKFZ erhalten Betroffene, Interessierte und Fachkreise individuelle Antworten auf alle Fragen zum Thema Krebs.
Um vielversprechende Ansätze aus der Krebsforschung in die Klinik zu übertragen und so die Chancen von Patientinnen und Patienten zu verbessern, betreibt das DKFZ gemeinsam mit exzellenten Universitätskliniken und Forschungseinrichtungen in ganz Deutschland Translationszentren:
Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.
