Stoffwechselanpassung sichert Darmkrebszellen das Überleben
Darmkrebszellen mit einem Defekt in p53, einem der wichtigsten Kontrollproteine des Zellwachstums, kurbeln einen bestimmten Stoffwechselweg an, um sich so an den Sauer- und Nährstoffmangel im Tumorinneren anzupassen. Statine – häufig verordnete Cholesterinsenker – blockieren diesen Stoffwechselweg und treiben die Krebszellen in den Tod, wie Wissenschaftler aus dem Deutschen Krebsforschungszentrum jetzt entdeckten. Die Forscher wollen diese mögliche Behandlungsstrategie nun im Labor weiter prüfen.
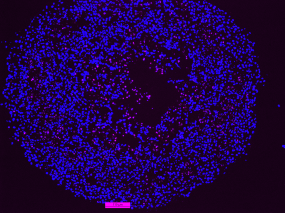
Im Inneren des Spheroids sterben Zellen am programmierten Zelltod Apoptose (pink)
© DKFZ/ Almut Schulze
Hat ein Tumor eine bestimmte Größe erreicht, so stehen die Krebszellen vor einer besonderen Herausforderung: Den ungeordnet wachsenden Tumoren fehlen Blutgefäße. Das führt zu Sauerstoffmangel im Inneren des Tumors und auch zu Engpässen in der Nährstoffversorgung. „Um sich an diese Mangelsituation anzupassen, müssen Krebszellen ihren gesamten Stoffwechsel grundlegend umstellen", erklärt Almut Schulze, Stoffwechselexpertin im Deutschen Krebsforschungszentrum.
Die Wissenschaftlerin ging nun mit ihrer aktuellen Arbeit Hinweisen nach, dass ein wichtiges Steuerprotein, der Tumorsuppressor p53, bei der Anpassung an die Mangelbedingungen eine entscheidende Rolle spielt. Um herauszufinden, wie sich p53 tatsächlich auf die Stoffwechselanpassung auswirkt, untersuchte Schulze mit ihrem Team Darmkrebszellen, denen p53 fehlte.
Um in der Kulturschale die Mangelsituation im Inneren einer Krebsgeschwulst zu simulieren, ließen die Forscher die Krebszellen zu kleinen Gewebekügelchen (Spheroide) heranwachsen. Darmkrebszellen mit intaktem p53 passten sich an die Mangelbedingungen im Inneren der Spheroide an, indem sie ihr Wachstum drosselten. Die Tumorzellen mit p53-Defekt dagegen wuchsen unbeirrt weiter. Dabei kurbelten sie einen Stoffwechselweg an, der die Versorgung mit dem wichtigen Zellmembranbestandteil Cholesterin ermöglicht, den so genannten Mevalonat-Weg.
Der Mevalonat-Stoffwechselweg lässt sich mit Statinen, gängigen Cholesterin-Senkern, hemmen. Und tatsächlich: Statinbehandlung löste unter den Mangelbedingungen im Inneren der p53-defizienten Mini-Tumoren den programmierten Zelltod – Apoptose – aus. Dagegen reagierten Mini-Tumoren mit intaktem p53 nicht auf die Medikamente.
Das Team um Schulze fand noch eine weitere Anpassung der p53-defekten Darmkrebszellen an die Mangelbedingungen: Der aktivierte Mevalonat-Stoffwechselweg kurbelte außerdem die Bildung von Ubichinon an, einem wichtigen Elektronen-Transporter in der Atmungskette. Krebszellen sind unter Mangelbedingungen vermehrt auf diese auch unter dem Namen Coenzym Q10 bekannte Substanz angewiesen, unter anderem für die Synthese neuer DNA-Bestandteile.
„Krebszellen mit defektem p53 nutzen den Mevalonat-Weg, um die Zellatmung zu fördern und um sich mit wichtigen Zellbausteinen zu versorgen, die ihr Überleben sichern. Aus Sicht der Krebsmedizin ist daran besonders interessant, dass sich dieser Stoffwechselweg gut mit Statinen hemmen lässt – so konnten wir mit einem gängigen Medikament Tumorzellen in die Apoptose treiben", erklärt Almut Schulze und ergänzt: „Allerdings gilt dies nur unter den speziellen Mangelbedingungen, wie sie im Inneren eines Tumors herrschen. Das bedeutet, dass Statine mit Wirkstoffen kombiniert werden sollten, die diesen metabolischen Stress fördern, etwa mit Substanzen, die die Gefäßneubildung hemmen." Die Wissenschaftlerin will diese neue Behandlungsstrategie nun so bald wie möglich an Tumorzellen und in Tierexperimenten erproben.
Irem Kaymak, Carina R. Maier, Werner Schmitz, Andrew,D. Campbell, Beatrice Dankworth, Carsten P. Ade, Susanne Walz, Madelon Paauwe, Charis Kalogirou, Hecham Marouf, Mathias T. Rosenfeldt, David M. Gay, Grace H. McGregor, Owen J. Sansom and Almut Schulze: Mevalonate pathway provides ubiquinone to 1 maintain pyrimidine synthesis and survival in p53-deficient cancer cells exposed to metabolic stress.
Cancer Research 2019, DOI: 10.1158/0008-5472.CAN-19-0650
Ein Bild zur Pressemitteilung steht zur Verfügung unter:
www.dkfz.de/de/presse/pressemitteilungen/2019/bilder/Cover-pic_Composite.png
BU:
Im Inneren des Spheroids sterben Zellen am programmierten Zelltod Apoptose (pink)
Nutzungshinweis für Bildmaterial zu Pressemitteilungen
Die Nutzung ist kostenlos. Das Deutsche Krebsforschungszentrum (DKFZ) gestattet die einmalige Verwendung in Zusammenhang mit der Berichterstattung über das Thema der Pressemitteilung bzw. über das DKFZ allgemein. Als Bildnachweis ist folgendes anzugeben: „Quelle: DKFZ/ Almut Schulze".
Eine Weitergabe des Bildmaterials an Dritte ist nur nach vorheriger Rücksprache mit der DKFZ-Pressestelle (Tel. 06221 42 2854, E-Mail: presse@dkfz.de) gestattet. Eine Nutzung zu kommerziellen Zwecken ist untersagt.
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Beim Krebsinformationsdienst (KID) des DKFZ erhalten Betroffene, Interessierte und Fachkreise individuelle Antworten auf alle Fragen zum Thema Krebs.
Um vielversprechende Ansätze aus der Krebsforschung in die Klinik zu übertragen und so die Chancen von Patientinnen und Patienten zu verbessern, betreibt das DKFZ gemeinsam mit exzellenten Universitätskliniken und Forschungseinrichtungen in ganz Deutschland Translationszentren:
Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.
